16時間断食を含めた断続的断食が日本のみならず世界でブームになっています。断続的断食は、たんに体重を減らすだけでなく、健康に様々なメリットをもたらします。他方で、デメリットもあるので、この記事では、断続的断食のメリットを享受しつつ、そのデメリットを克服する方法を考えたいと思います。
1. 断続的断食とは何か
この章では、断続的断食とは何かという定義の話から始めて、それがどのような効果をもたらすのか、そしてどのようなメカニズムでそのような効果をもたらすかを述べます。
1.1. 断続的断食の定義
断続的断食(Intermittent Fasting)とは、減量、生活習慣病対策、アンチエイジングのために12時間を超える断食時間と通常の食事を循環させる食餌療法のことです。断食時間をどの程度の長さにするのか、断食時間中水しか飲ませないのか、制限食も認めるのかによってさまざまな種類がありますが、代表的なのは、以下の三類型です。
- 日替わり断食(Alternate-Day Fasting):通常食の日と断食の日とを日替わりにする方法。狭義には隔日で断食する方法を指しますが、それでは厳しすぎるので、1週間のうち2日断食する5:2ダイエットの方が一般的です。本稿では、5:2ダイエットも含めた広義の一日単位の断食にこの名称を使うことにします。
- 修正日替わり断食(Modified Alternate-Day Fasting):断食の日にカロリー制限食や絶食模倣食の摂取を認めるゆるやかな日替わり断食法。
- 時間制限食(Time-Restricted Feeding):日替わり断食とは異なり、断食の時間を24時間未満に、したがって、循環を一日単位に抑える方法。通常食の摂取時間を覚醒時間の前半に限定する早期時間制限食(Early Time-Restricted Feeding)と後半に限定する遅延時間制限食(Delayed Time-Restricted Feeding) の二種類があります。
海外では、日替わり断食および修正日替わり断食が最初に流行し、後に、時間制限食が人気となりました。日本では、青木厚著『「空腹」こそ最強のクスリ』により、時間制限食が16時間断食ダイエットの名で有名になりました。日替わり断食も、月曜日だけ断食する月曜断食という形で実践している人も日本にいるようですが、たとえカロリー制限食を認めるにせよ、一日中断食するのはハードルが高いので、一日二食にするだけの16時間断食ダイエットの方がポピュラーです。
従来の伝統的なダイエットであるカロリー制限には、カロリー計算が面倒という短所がありました。断続的断食は、この短所がないダイエットとして人気を博しています。非断食時間には満腹になるまで食べてもよいとはいえ、一回に食べる量には限度がありますから、自然にカロリー制限がなされることになります。しかし、断続的断食にはそのような実行の容易さ以上の長所はないのでしょうか。
1.2. 断続的断食の効果
まずは、断続的断食のダイエット効果を、2021年発表のメタアナリシス[1]で確認しましょう。合計2225人の被験者を対象とした46のランダム化比較試験をまとめたこのメタアナリシスによると、断続的断食と通常食との結果の加重平均差は、
- 体重(-1.78kg, 95%信頼区間:-2.21~-1.35)
- ウエスト周囲径(-1.19cm, 95%信頼区間:-1.8~-0.57)
- 脂肪量(-1.26 kg, 95%信頼区間: -1.57 to -0.95)
- 収縮期血圧(-2.14 mmHg, 95%信頼区間:-3.54~0.73)
- 拡張期血圧(-1.38 mmHg, 95%信頼区間:-2.35~-0.41)
- 空腹時血糖値(-0.053 mmol/L, 95%信頼区間:-0.105~0.001)
- 空腹時インスリン(-0.8 mIU/L, 95%信頼区間:-1.15~-0.44)
- インスリン抵抗性(-0.21, 95%信頼区間:-0.36~-0.05)
- 総コレステロール(-0.10 mmol/L, 95%信頼区間:-0.17~-0.02)
- 中性脂肪(-0.09 mmol/L, 95% 信頼区間:-0.13 ~-0.04)
で有意(p <0.05)となりました。これらはいずれも、生活習慣病予防という点で好ましい変化を断続的断食がもたらしたことを示しています。
断続的とはいえ、断食すればそうなるのは当たり前と思うかもしれません。そこで次に、伝統的なダイエットである継続的カロリー制限と効果を比べてみましょう。18の研究の結果をまとめた2021年発表のメタアナリシス[2]によると、断続的断食は、継続的カロリー制限と比較して、4つの研究でより大きな体重減少、5つの研究で脂肪量のより大きな減少と関連付けられていて、継続的カロリー制限に勝るとも劣らぬダイエット効果を発揮しています。
ただし、断続的断食は最近の流行であるため、ほとんどの研究でフォローアップの期間が短く、それゆえ、長期的に見ても安全で効果的なダイエット方法であると現時点では断定できません。前回、動物性タンパク質を過剰に摂取する糖質制限が死亡率を高めるという話をしましたが、断続的断食はどうなのかとみなさんは心配するかもしれません。死亡率に関する調査はありませんが、研究者たちは、カロリー制限と同様に、断続的断食が「脊椎動物および無脊椎動物のモデル生物の両方で寿命を延長する[3]」ことを確認しているため、人間でも死亡率を低下させると予想しています。実のところ、断続的断食は時間限定のカロリー制限であり、断食中、カロリー制限をした時と同じような変化をもたらすと考えられます。そのメカニズム(機序)を次に説明しましょう。
1.3. 断続的断食の機序
断食で栄養、とりわけ糖質の供給が途絶えると、既存の血糖が消費されて、グルコース不足になります。肝臓や筋肉などに蓄えられているグリコーゲンまでが枯渇しそうになると、エネルギー源がグルコースから脂肪由来のケトン体に切り替わる「メタボリック・スイッチ[4]」が入ります。ケトン体は、もともと糖尿病性ケトアシドーシスから発見されたため、かつては危険視されていましたが、インスリンが正常に働く非糖尿病患者の場合、ケトン体が増えても何の問題もありません。
脂肪酸の代謝で生成するケトン体のうち、呼気から排出されるアセトンを除いたアセト酢酸とD-β-ヒドロキシ酪酸は、グルコースに代わるエネルギー源になるだけでなく、FFA3(GPR41)やFFA2(GPR43)などの細胞膜上受容体を介して生体調節に関与するシグナル分子にもなります。すなわち、交感神経活性や体温上昇といったエネルギー代謝を促すFFA3(GPR41)をD-β-ヒドロキシ酪酸が抑制する[5]一方で、脂肪組織の増大を防ぐFFA2(GPR43)をアセト酢酸が活性化させる[6]ことがわかっています。
ケトン体の生成は活性酸素を発生させますが、ケトン体のD-β-ヒドロキシ酪酸は、それ自体が抗酸化作用を持ち、ミトコンドリアにおける活性酸素の生成を抑制します。さらに、D-β-ヒドロキシ酪酸はストレス応答性転写因子のNrf2(Nuclear factor-erythroid factor 2-related factor 2 核因子赤血球因子2関連因子2)を活性化することで、多くの抗酸化遺伝子を発現するので、ケトン体の生成は、最終的にはむしろ抗酸化を促進するホルミシス効果を発揮する[7]とさえ言えます。また、Nrf2は、p53の抑制を介して、mRNAおよびタンパク質レベルでサーチュイン遺伝子、特に、SIRT1(Silent mating type information regulation 2 homolog 1 サイレント交配型情報制御2ホモログ1)を間接的に活性化させることも知られています[8]。
サーチュイン遺伝子は、老化の速度や寿命の長さに影響を与えることから、長寿遺伝子とも呼ばれています。カロリー制限の本来の目的は、たんに内臓脂肪を減らして生活習慣病を治療あるいは予防するだけでなく、サーチュイン遺伝子の発現を通じて老化を遅らせるところにあります。メタボリック・スイッチを入れるだけなら、糖質制限でも可能ですが、断食あるいはカロリー制限で特筆すべきは、サーチュイン遺伝子の発現です。これをメタボリック・スイッチに倣って、サーチュイン・スイッチと呼ぶことにしましょう。そこで、次に、カロリー制限がサーチュイン・スイッチを入れ、抗老化(アンチエイジング)作用を発揮するメカニズムを説明することにします。
私たちが経口摂取する栄養素は、以下の図に描かれているように、糖質であれ、脂質であれ、タンパク質であれ、アセチルCoAに変換された後、クエン酸回路に入り、異化されます。
![栄養素の異化[9]。](https://lani.co.jp/wp-content/uploads/2022/05/catabolism-nad-nadh-adp-atp.png)
栄養素の異化[9]。私たちは、体の外で化石燃料を燃やして発電しています。化学的に表現すると、石炭、石油、天然ガスといった有機体の資源は、酸素という酸化剤によって電子を奪われ(同時に、酸素は電子を受け取って、還元され)、エネルギーを放出します。体の中でも同じような酸化還元反応が起きていて、それにより、栄養素から生きていくのに必要なエネルギーが取り出されます。その際、酸化剤として電子伝達系で媒介的に使われるのが、NAD+、すなわち、ニコチンアミド・アデニン・ジヌクレオチド(Nicotinamide Adenine Dinucleotide)です。NAD+は、酸化剤として、クエン酸回路の代謝中間体を酸化することで、自身はNADHへと還元されます。NADHは、還元剤として、ADPをATPへと還元し、自身はNAD+へと酸化されます。
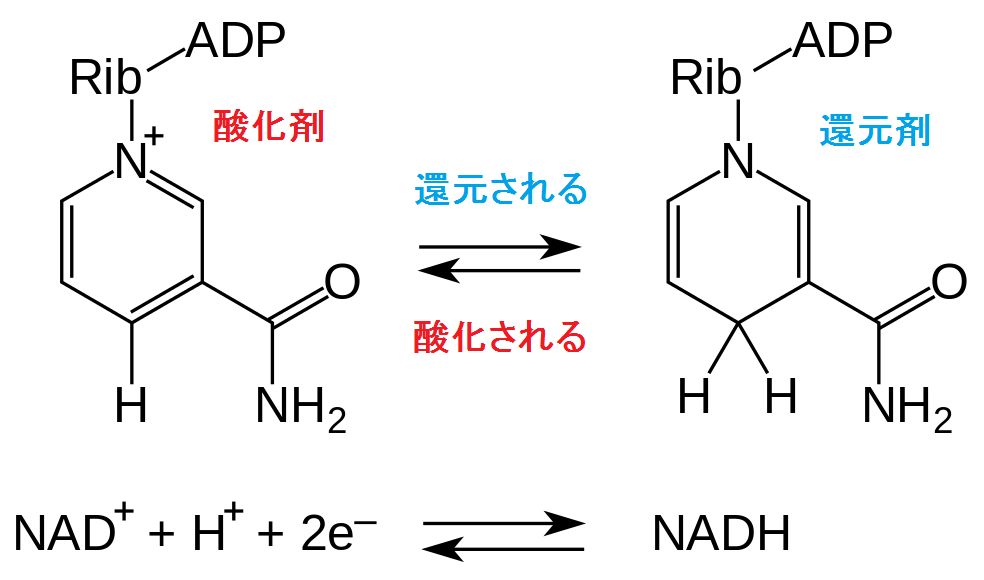
ニコチンアミドアデニンジヌクレオチドの酸化還元反応[10]飽食の時には、「栄養素の異化」の図で青色の線で囲んだ栄養素が増え、NAD+に対するNADH、ADPあるいはAMPに対するATPが相対的に増えます。つまり赤色の線で囲んだNAD+とADPあるいはAMPが相対的に減ります。断食したり、カロリー制限したりすると、NAD+/NADH比と(ADP+AMP)/ATP比が増加し、SIRT1やAMPKを発現させます。SIRT1は、酵母の長寿遺伝子 Sir2[11]の哺乳類におけるホモログ(相同性のある遺伝子)、すなわちヒトの寿命を司るサーチュイン遺伝子です。
SIRT1は、さらにFoxO(Forkhead box O)の発現を通じて、Atg(Autophagy-related genes)を発現させ、オートファジーを促進させます[12]。オートファジーとは、細胞内の老化したタンパク質や病原菌など有害なタンパク質をリソソームで分解し、それを新たなタンパク質の合成やエネルギーの生産に再利用する自食作用のことです。断食やカロリー制限をしないとオートファジーが一切行われないということはありませんが、栄養不足になった時の方が促進されます。それは、例え話を使うなら、ショートケーキがたくさんある時、子供たちは、ホイップクリームやイチゴなどおいしい所だけ食べて、スポンジケーキを食べ残すでしょうが、それらの提供を受け取れなくなって、おなかがすけば、それまで見向きもしなかった食べ残しまで食べて、皿の上をきれいにするようなものです。オートファジーが行う細胞の掃除は、老化によって起きる疾患の原因を取り除き、細胞を若返らせるのに重要な役割を果たします。
AMPKも、SIRT1と同様、栄養不足になった時に発現する遺伝子で、オートファジーや脂肪酸化などによりエネルギー恒常性を維持しようとします。運動によるストレスに対応して、筋肉における血管内皮増殖因子を発現させ、血管新生を促進し、筋細胞への血液供給の増加に関与することもわかっています[13]。以下の図に示した通り、AMPKとSIRT1の間には、相互に強め合う作用があります。
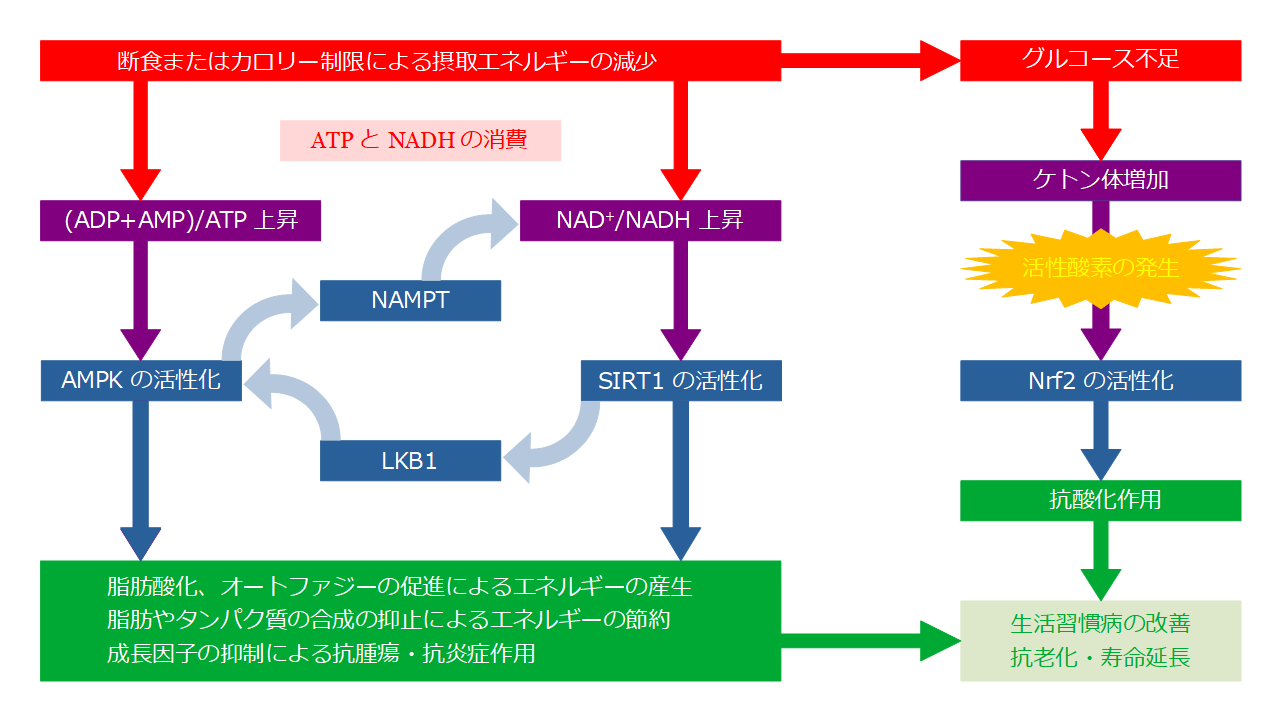
断食およびカロリー制限の効果
以上を要するに、断食でエネルギー源が途絶えると、Nrf2、SIRT1、AMPKが発現し、貯蔵用の脂肪やタンパク質のゴミがエネルギー源として使用され、結果として、生活習慣病の原因となる内臓脂肪や老化の原因となるタンパク質のゴミが取り除かれるということです。このように、断食やカロリー制限は健康に好ましい結果をもたらしますが、メリットだけでなくデメリットもあるので、次の章では、デメリットをどう克服するかを考えましょう。
2. ダイエットの弊害とその克服法
カロリー制限、糖質制限、断続的断食は、三大ダイエット方法と言ってよいほど人気があります(そして、この順に流行しました)。糖質制限の弊害とその克服法については、前回取り上げたので、ここでは、カロリー制限と断続的断食の弊害とその克服法について述べます。
2.1. カロリー制限の弊害とその克服法
2018年のメタアナリシス[14]によると、カロリー制限による体重変化の平均標準偏差が−4.73±1.2kgであったのに対して、脂肪を除く体重のそれは−0.76±0.1kgでした。また、筋組織単位あたりの力の生産量として定義される筋質の変化率は、-7.5±9.9%で、筋力の低下が確認されます。50〜60歳の健康な男女18名に12ヶ月間カロリー制限させた試験[15]の結果によると、体重の変化率が-10.7±1.4%であったのに対して、除脂肪体重(脂肪を除いた筋肉などの重さ)の方は-3.5±0.7%でした。筋肉の衰えを詳しく調べると、大腿筋量が-6.9±0.8%、膝屈曲筋力が-7.2±3%の変化率となっていました。有酸素運動能力の基準である最大酸素摂取量(VO2Max)も、-6.8±2.3%の変化率を示しました。筋肉と運動能力が減衰したということです。
カロリー制限で体重が減って、安心してダイエットを止めると、リバウンドするというよくある失敗の原因は、脂肪とともに筋肉量までが減るところにあります。筋肉量が減ると、基礎代謝量も減るので、ダイエットを止めて通常食に戻すと、栄養が脂肪として蓄えられやすくなって、太ってしまうのです。リバウンドしたからといって、同じダイエットを繰り返せば、悪循環になります。筋肉量の減少は、加齢に伴って発生しやすくなるサルコペニアを悪化させ、運動機能の低下(ロコモティブ・シンドローム)のリスクを高めます。ロコモティブ・シンドロームで運動不足になると、それが再び筋肉量の減少をもたらすので、悪循環はさらに続くことになります。
カロリー制限は、筋肉だけでなく、骨密度をも減らすことが知られています。2016年のメタアナリシス[16]によると、カロリー制限で減量すると、4ヶ月以上経過で股関節の骨密度(平均差:-0.008g/cm2, 95%信用区間:-0.09~-0.006g/cm2)を、13ヶ月以上経過で腰部の骨密度(平均差:-0.018g/cm2, 95%信用区間:-0.019~-0.017g/cm2)を有意(p<0.001)に低下させます。筋肉量の減少に骨密度の低下が加わることで、ロコモティブ・シンドロームになるリスクがさらに高まります。
カロリー制限が骨密度を低下させる詳しいメカニズムはまだよくわかっていないものの、カロリー制限によるインスリンの減少が、骨芽細胞による骨の形成を妨げる一因になっているようです。マウスを用いた実験[17]から、ミトコンドリアのサーチュイン遺伝子(SIRT3)が骨量減少にかかわっているという見解も出されています。ちょうど、オートファジーが筋肉の新陳代謝に寄与するように、破骨細胞による骨の破壊は骨の新陳代謝に寄与しているので、破骨細胞による骨の破壊は、それ自体決して悪いことではないのですが、骨芽細胞による骨の再生が不十分だと、骨密度が低下してしまいます。
幸い、骨密度の低下は、断続的断食で防げそうです。2019年のシステマティック・レビュー[18]は、断続的断食は、継続的カロリー制限と異なり、骨密度を低下させないようだという見解を示しています。ラットを用いた12週間の実験結果[19]によると、隔日ケトン体ダイエットは、連続的なケトン体ダイエットと比較して、高いケトン体濃度を実現しつつも、破骨過程と初期骨形成の分化を抑制するという結果が得られ、それゆえ、連続的なケトン体ダイエットほど骨の微細構造や強度を悪化させない可能性があるとのことです。
では、断続的断食は、筋肉量の減少をも阻止できるのでしょうか。英国の研究者たちが2018年に発表したメタアナリシス[20]によると、継続的カロリー制限に対する断続的断食の加重平均差は、脂肪量では、-1.38kg (95%信用区間:-2.47~-0.28kg) と有意でした(p=0.014)が、除脂肪体重では、-0.02kg(95%信用区間:-0.80~0.76kg)で、有意ではありませんでした(p=0.958)。ただし、このメタアナリシスが対象とした断続的断食は、修正日替わり断食です。英国では、2012年8月に放映されたBBCの人気ドキュメンタリー番組 “Horizon” で、5:2ダイエット(一週間のうち二日でカロリー制限するダイエット)が取り上げられ、ブームになったのを受け、研究者たちは、流行のダイエット法の効果を検証しようとしたのですが、継続的カロリー制限と同様、修正日替わり断食でも、それだけでは筋肉量の減少を阻止できなかったということです。
2020年のシステマティック・レビュー[21]によると、レジスタンス運動(筋力トレーニング)を併用すれば、断続的断食でも筋肉量は減らないとのことですが、同じことは、継続的カロリー制限でも言えます。2018年のメタアナリシス[22]によると、レジスタンス運動の併用は、カロリー制限による除脂肪体重の減少を93.5%減らすとのことです。
もとより、恒常的なカロリー制限と筋力トレーニングとの併用は、かなりハードルの高い要求です。ほとんどの人は、空腹の時に運動しようという気にはなれません。この点、断続的断食なら、空腹ではない非断食期に運動すればよいので、実践が容易です。ハードルの低さ、続けやすさという点で、断続的断食はカロリー制限より優位にあります。
日替わり断食よりも断食時間が短い時間制限食の場合はどうでしょうか。2020年のメタアナリシス[23]によると、対照群(開始前など通常食)と比べた時間制限食の固定効果モデルによる平均差は、
- 体重で、-0.90(95%信用区間:-1.71~-0.10)
- 脂肪量で、-1.58(95%信用区間:-2.64~-0.51)
- 収縮期血圧で、-3.07(95%信用区間:-5.76 to -0.37)
- 空腹時血糖値で、-2.96(95%信用区間:-5.60 to -0.33)
- 中性脂肪で、-11.60(95%信用区間:-23.30 to -0.27)
の有意差があったのに対して、除脂肪体重では、-0.24(95%信用区間:-1.15~0.67)と有意差がありませんでした。筋肉量や骨量が保存されたということです。もっとも、2021年のメタアナリシス[24]は、時間制限食が除脂肪体重を減らすとしています。
時間制限食の効果を検証したランダム化比較試験はまだ数が少なく、決定的な結論は出ていませんが、どのようなダイエットをするにせよ、一方で、筋肉や骨を作るための栄養素を十分に摂取しつつ、他方で運動によって筋肉と骨に負荷をかけ、筋肉や骨が衰えないようにしなければなりません。筋肉や骨を作るための栄養素として必要なのは、
- タンパク質
- カルシウム
- ビタミンD
- ビタミンK
- ビタミンB群
です。ビタミンDは食事からも摂取できますが、日光を浴びることで体内でも合成できるので、日光を浴びて運動をすることは一石二鳥であると言えます。
とはいえ、タンパク質の摂取は、血清IGF-1濃度を上昇させる[25]ので、カロリー制限による寿命延長を目指す人にとっては、諸刃の剣です。IGF-1(Insulin-like Growth Factor インスリン様成長因子1)は、その名の通り、インスリンに類似した分子構造を持つ成長ホルモンで、インスリン(INS)とともに、
INS/IGF-1 → SHC-Grb2-SOS → Ras → Raf → MEK → ERK → 細胞の増殖と分化
というカスケードを開始し、細胞の増殖と分化を促します。細胞の増殖と分化のためには、細胞の材料であるタンパク質と脂質の合成が必要なので、
INS/IGF-1 → IRS → PI3K → PIP3 → PDK → Akt → mTOR → タンパク質と脂質の合成
というカスケードにより、mTORを活性化し、タンパク質と脂質を合成させ、筋肉量を維持します。このカスケードを成長促進カスケードと呼ぶことにしましょう。
成長促進といえば聞こえはよいのですが、成長と老化は一続きになっていて、成人以降成長が促進されると、老化が進みます。また、成長促進カスケードは、正常な細胞だけでなく、ガン細胞をも成長させ、死亡率を高めます。2014年の米国での調査結果[26]によると、タンパク質摂取量が多い50~65歳は、少ない人と比べて、18年後のガンによる死亡リスクが約4倍(ハザード比:4.33, 95%信用区間:1.96~9.56)増加し、全原因死亡率も74%増加した(ハザード比:1.74, 95%信用区間:1.02~2.97)とのことです。但し、66歳以上の場合、むしろ高タンパク質摂取者の方がガンおよび全原因の死亡率が低くなりました。成長促進カスケードが自然に弱まるからのようです。
継続的なカロリー制限では、成長促進カスケードを十分に抑制できないことが判明しています。2019年のメタアナリシス[27]によると、16時間以上の断食が、IGF-1を有意に減少させる(加重平均差:-28.87 ng/ml, 95%信用区間:-43.69~-14.05, I2=0%)のに対して、継続的なカロリー制限は通常の1日のエネルギー摂取量を50%以上制限しないと、IGF-1レベルを有意に低下させられない(加重平均差:–36.57 ng/ml, 95%信用区間:-59.19~-13.95, I2=0%)とのことです。継続的に1日のエネルギー摂取量を50%以上カットすることは不可能なので、継続的なカロリー制限では、成長促進カスケードの抑制は難しいと言わねばなりません。

抗老化カスケードと成長促進カスケードのディレンマ
SIRT1の発現によって始まる抗老化カスケードと成長促進カスケードは、相互に抑制し合う関係にあります。継続的なカロリー制限では、抗老化カスケードの活性化も成長促進カスケードの抑制も不十分で、それでいて、筋肉量の減少や骨密度の低下を防げないとするなら、すべてにおいて中途半端と言わざるを得ません。16時間以上の断食時間と自由摂食時間を循環させる断続的断食なら、断食時間にサーチュイン・スイッチを入れ、成長促進カスケードを抑制し、オートファジーを促進した後で、自由摂食時間にサーチュイン・スイッチを切り、成長促進カスケードを活性化し、筋肉と骨を再生させるサイクルを繰り返して、新陳代謝を促せます。抗老化カスケードと成長促進カスケードを交互に繰り返す断続的断食は、メタボリック・シンドロームとロコモティブ・シンドロームの両方を防止し、老化を遅らせつつ生活の質をも維持できるという点で、虻蜂取らずになっているカロリー制限より優位にあると言えます。
2.2. 長時間断食の弊害とその克服法
断続的断食がカロリー制限より優位にあるなら、今日本で流行している16時間断食で良いと思うかもしれません。しかし、16時間断食には、カロリー制限にはない、断食一般に共通する弊害があります。それは、胆石リスクの増大です。特に女性は男性よりも胆石になる人が多いので、ダイエットに熱心な女性は胆石リスクに注意する必要があります。
胆石とは、胆嚢にできる結石で、胆嚢結石とも言います。胆嚢は、以下の図に示したように、肝臓と十二指腸との中間にある臓器です。
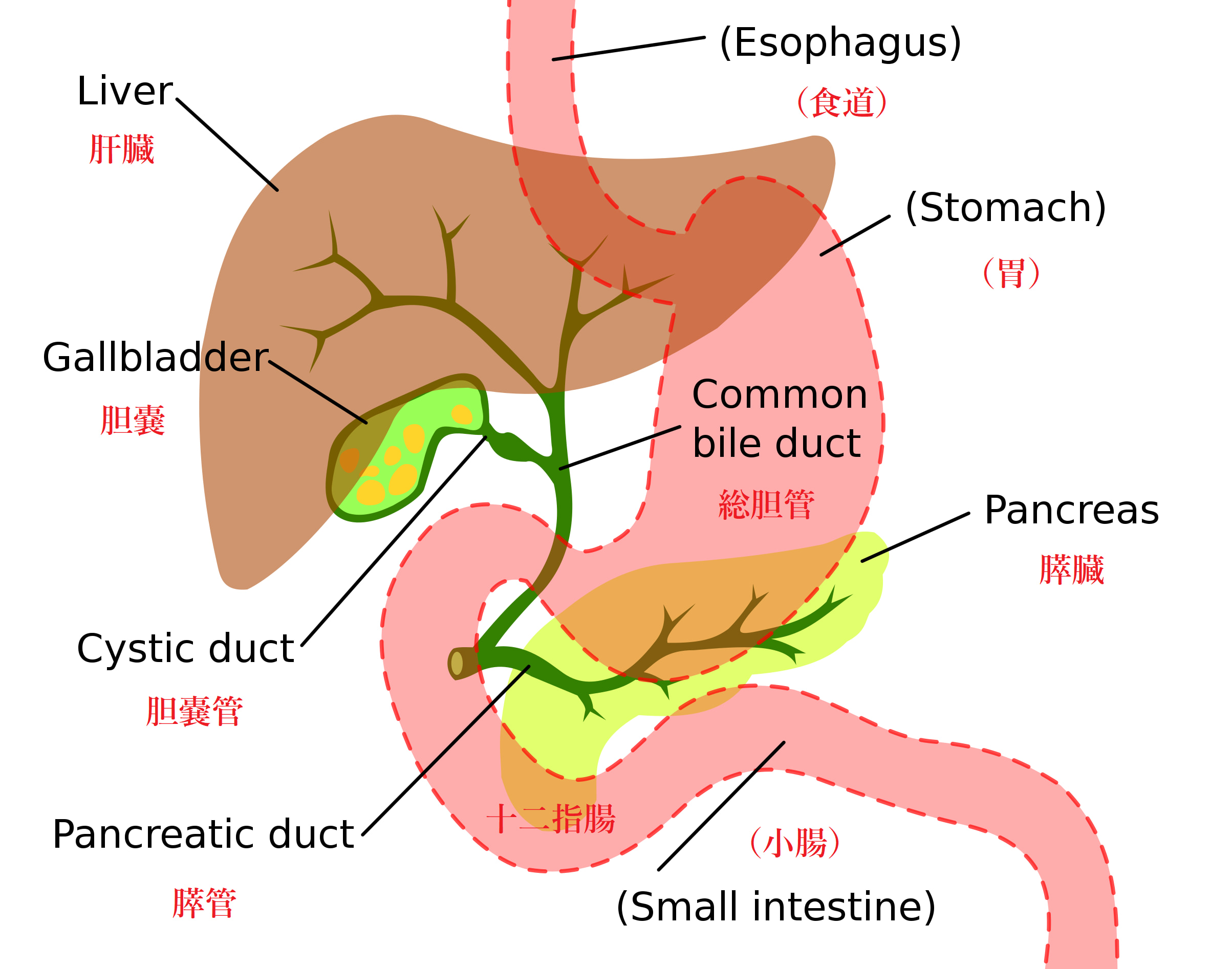
胆嚢と関連臓器[28]
胆嚢内の濃縮胆汁が結石になる原因は、いろいろありますが、長時間の断食や無理なダイエットも原因の一つと考えられています。米国人女性を10年間フォローアップした研究[29]によると、摂取エネルギーで調節した胆嚢結石になるハザード比は、ダイエットで、1.66(95%信用区間:1.21~2.26)、8時間を超える断食時間で、1.29(95%信用区間:1.09~1.53)であることが判明しました。特に断食時間が16時間だと、8時間の時と比べて胆石症になるハザード比が倍になるという事実は、16時間断食の大きな弊害と言わなければなりません。
胆嚢結石で命を落とす人もいます。2016年のメタアナリシス[30]によると、胆石症になった場合、そうでない場合と比べた多変量調整ハザード比が、肝胆道がんの死亡率で、2.74(95%信用区間:1.83-4.10)、肝臓がんの死亡率で、2.34(95%信用区間:1.45-3.77)、胆嚢がん死亡率で、7.35(95%信用区間:2.60-20.8)でした。そうなる前に、胆嚢ごと摘出すれば根治すると思うかもしれません。たしかにそうすれば、当面の危機は回避できますが、総胆管結石や肝内結石まで防ぐことはできません。
また、胆石症になると、膵臓がんのリスクも増えることが知られています。2016年の別のメタアナリシス[31]によると、膵臓がんの相対リスクは、胆嚢結石で1.70(95%信用区間:1.30~2.21)、胆嚢摘出術で1.31(95%信用区間:1.19~1.43)と有意に(P<0.001)高く、胆石症と胆嚢摘出術がそれぞれ膵臓がんの独立した危険因子であることを示しています。膵臓がんは治療が困難ながんですから、胆嚢結石のリスクを過小評価してはいけません。
胆嚢結石を防ぐには、断食時間の途中で、胆嚢内で濃縮された胆汁を排出させる必要があります。そのために必要な脂質の量は、10g程度です[32]。それなら、10gの脂質を含む低カロリーな超軽食を絶食模倣食(fasting-mimicking diet)として、断食時間中に摂取すればよいということになります。絶食模倣食を許容する時間制限食を、修正日替わり断食に倣って、修正時間制限食と呼ぶことにしましょう。絶食模倣食とは、断食で入ったメタボリック・スイッチとサーチュイン・スイッチを切らない食品です。絶食模倣食として、具体的にどのような食材を選ぶかは、次の章で取り上げることにします。
2.3. 修正時間制限食に弊害はないのか
カロリー制限、糖質制限、断続的断食のリスクをまとめましょう。
- カロリー制限:筋肉量減少や骨密度低下のリスク
- 糖質制限:腎機能悪化や腸内環境悪化のリスク
- 断続的断食:胆嚢結石のリスク
修正時間制限食は、三つのダイエットのベネフィットを享受しながら、これらのリスクを低下させるダイエットと言えます。非断食時間に十分な栄養を取って、運動することで、筋肉量減少や骨密度低下のリスクを低減し、糖質制限を三食のうちの一食に限定することで、腎機能悪化や腸内環境悪化といった糖質制限のリスクを低減し、断食時間中に絶食模倣食を摂取することで、胆嚢結石という16時間断食のリスクを低減するからです。
では、修正時間制限食に弊害はないのかと問う人もいるでしょう。現在知られている弊害の一つに、男性ホルモンのテストステロンが減るというのがあります。2016年のイタリアの研究[33]によると、筋肉トレーニングをしている男性34人を二つのグループに分け、処置群の被験者には、午後1時、4時、8時に食事をとらせ、対照群の被験者には午前8時、午後1時、午後8時に食事をとらせたところ、8週間後、処置群の男性のテストステロンが対照群と比べ、有意に減少したというのです。テストステロンの減少は死亡率の上昇と相関性がある[34]ので、これは男性にとっては気になるところです。
しかし、2020年の米国での実験結果[35]は、2016年のイタリアの研究とは異なる結論を出しています。同じような実験をしたものの、調査期間中のどの時点でも、処置群と対照群との間で、テストステロンに有意差が確認されなかったというのです。著者たちは、血清テストステロンのレベルが24時間を通して43%も変動することから、たとえ有意差があったとしても、時間制限食が原因とは限らないとしています。それゆえ、テストステロンの減少が時間制限食の弊害かどうかはまだわかりません。
時間制限食の副作用として、空腹感以外に、めまい、頭痛、吐き気などが挙げられますが、稀な上にそれほど深刻ではないことから、今のところ、短期的には安全なダイエット方法と評されています[36]。但し、最近の流行であるため、長期にわたって実践した場合の影響は未知であり、まだ知られていないリスクが判明する可能性があります。もとより、時間制限食の一種であるラマダーンは、イスラム教徒によって長期にわたって実践されていますが、今のところ大きな健康被害は報告されていない[37]ので、他のタイプの時間制限食もおそらく安全であろうと考えられています。この世にゼロリスクというものが存在しない以上、完全な安全性は保証しかねますが、ダイエットしないことにも、生活習慣病の悪化や老化の加速といったリスクがある以上、どちらのリスクの方がより小さいかを各人が考えて判断すべきでしょう。
3. 修正早期時間制限食の提案
断続的断食には、断食の長さや開始時期の違いによっていくつかの類型があります。この章では、どの類型が最も好ましいかに関する私の見解を示します。
3.1. 断食時間は何時間が最適なのか
冒頭で述べたように、断続的断食には様々な類型があります。どれを選ぶかを決める上で重要な問題の一つは、断食時間は何時間が最適なのかという問題です。健康な男性ボランティア6名を対象に、断食から12時間後、18時間後、24時間後、30時間後、42時間後、54時間後、72時間後の脂質代謝の漸進的変化を安定同位体トレーサーと間接熱量計を用いて評価した1993年の研究[38]によると、脂肪が最も酸化される時間帯は、18時間後から24時間後ということで、オートファジーもこの時間帯に活性化すると予想されます。それゆえ、16時間断食だと、時間が短すぎるかもしれません。もとより、断食時間が16時間でも、一日の摂取カロリーが少なければ、カロリー制限としての効果はあるでしょうが、抗老化カスケードと成長促進カスケードとを切り替える断続的断食のメリットを十分享受できない可能性があります。
他方で、断食時間は、長ければ長いほど良いということもありません。断食時間が長いと、たとえ絶食模倣食を摂るにせよ、空腹に耐えにくくなるとか、栄養不足に陥りやすくなるとかといった問題が生じますが、それに加えて、マイトファジー(ミトコンドリアのオートファジー)の効果という点でも、問題があります。ミトコンドリアは、酸素呼吸を通して細胞エネルギーを生産する重要な役割を担っているので、マイトファジーはとりわけ重要なオートファジーです。マウスの心臓を用いた実験[39]によると、心臓切片におけるマイトファジーのイベント数は、24時間の絶食で44.2%増加したのに対して、48時間の絶食では、24時間の絶食時のイベントと比較して50.1%減少し、コントロールの給餌動物と比較しても28%減少したとのことです。ヒトにも同じことが当てはまるかどうかという不確定性はあるにせよ、断食時間は、18時間以上24時間以下にするのが適当のようです。
断食時間は、18時間以上24時間以下が最適だとするなら、16時間断食では短すぎで、日替わり断食では長すぎということになります。16時間断食では、摂食が許される時間帯が8時間ですが、その時間帯を短縮すれば、16時間以上24時間以下という断食時間の目標を達成できます。時間制限食の摂食時間帯を短くしていくと、究極的には、一日一食(OMAD=One Meal a Day)ダイエットになります。一日一食ダイエットは、最も過激な時間制限食で、本当にそれで健康を維持できるのか疑問に思う人もいるでしょうが、日本にも一日一食ダイエットの実践を公言する著名人が少なからずいるので、必ずしも不可能とは言えません。
一日一食ダイエットの効果に関する研究はあまりないのですが、2022年にランダム化比較試験の結果[40]が公表されたので、それを紹介しましょう。11名(男5人+女6人)の参加者を、同じカロリーの食事を11日間夕食1食で摂取するグループと朝食、昼食、夕食の3食で11日間摂取するグループに交互に分ける無作為クロスオーバー試験を実施したところ、夕食1食のグループは、3食のグループと比較して、体重、脂肪量、午後の血漿グルコース濃度を有意に低下させ、運動脂肪酸酸化量を有意に増加させた一方で、除脂肪体重、骨密度、エネルギー消費量、運動能力に有意差はなかったとのことです。唯一の有害な結果は、LDLコレステロール値が有意に高くなったことぐらいで、全般的に見て、良好なダイエット効果があったと言えます。
しかし、これはあくまでも、11日間という短期の試験の結果にすぎません。長期的に実践した場合の効果がどうなのかはわかりません。仮に一日一食ダイエットもしくはそれに近い時間制限食を最終的に目指すにせよ、まずは、それよりもハードルが低い一日二食の時間制限から始めた方が無難です。ほとんどの人は、それで十分なはずです。
3.2. 早期時間制限か遅延時間制限か
時間制限食には、摂食時間帯をどの程度の長さにするかという問題に加え、一日のどこに設定するかという問題もあります。要するに、朝食を抜く遅延時間制限食を選ぶか、夕食を抜く早期時間制限食を選ぶかという問題です。多くの人は、朝起きた時には食欲がなく、夕食よりも朝食を抜く方が容易なので、遅延時間制限食を選ぼうとします。しかし、時間生物学(あるいは時間栄養学)的には、早期時間制限食の方が好ましいと考えられています。
時間生物学とは、生物に内在する体内時計を研究する学問で、栄養学の分野では、特に時間栄養学と呼ばれます。私たちの体には、ほぼ24時間で一巡する概日リズム(circadian rhythm)があります。概日とは「おおよそ一日」という意味です。このおおよそ一日のサイクルは、実際には、24時間より少し長いので、朝起きた時に、日光を浴びて、概日リズムをリセットしなければなりません。さもなければ、概日リズムのフリーランにより、起きている時間が少しずつ後退して、昼夜逆転の生活になってしまいます。就寝前にブルーライトを浴びることで体内時計に狂いが生じることもあります。
体内時計は体内のほぼすべての細胞にあるのですが、その中枢とも言うべきペースメーカーは、視交叉上核にあります。この中枢のペースメーカーは、明暗のサイクルに基づいて時を刻み、各体内時計の位相を調律しています。しかし、末梢組織の体内時計は、食事と身体活動のサイクルから影響を受けます。空腹になると、つまり、NAD+の濃度が相対的に高まると発現するサーチュイン遺伝子(SIRT1)は体内時計の遺伝子(CLOCK:BMAL1)の発現を制御することがわかっています[41]。他方で、これらの体内時計の遺伝子の概日的な発現は、NAD+の再利用経路の速度を律する酵素、NAMPT(NicotinAMide PhosphoribosylTransferase ニコチンアミド・ホスホリボシル転移酵素)の、したがって、NAD+の濃度の概日的な発現を制御している[42]ので、代謝のリズムと体内時計のリズムの間には相互制御の関係があると言えます。このことは、摂食リズムの乱れが睡眠覚醒リズムの乱れをもたらす一方で、睡眠覚醒リズムの乱れが摂食リズムの乱れをもたらすということです。この悪循環は、代謝異常と老化を促進するので要注意です。
サーチュイン遺伝子の発現は、NAD+に依存しますが、睡眠ホルモンのメラトニンにも依存しています。メラトニンは、起床時に光を浴びると分泌が止まり、夜暗くなると、分泌が始まり、眠気を誘います。また、メラトニンには、インスリン分泌抑制作用もあります。朝起きて朝食を摂る時には、メラトニンの分泌が止まり、サーチュイン遺伝子の発現が抑制され、インスリンが分泌され、かつ、インスリン感受性が高まります。朝食で糖質を摂取しても、血糖値が上がりにくいのは、このためです。他方で、夜、メラトニンの分泌が始まり、サーチュイン遺伝子を発現すべき時に、食事を摂ると、体内時計の正常な周期に悪影響を与えます。また、インスリンの分泌が抑制され、かつ、インスリン感受性が低下する時に、糖質を摂取すると、血糖値を急上昇させることになりかねません。
起床後は、メラトニンと入れ替わるように、コルチゾールの分泌が増加します。朝食を食べないと、グルコース不足を解消するために、コルチゾールが筋肉を分解し、肝臓での糖新生を促します。これでは、筋肉量が減ってしまいます。朝食時に糖質とタンパク質を十分摂取すると、インスリン(INS)とIGF-1が増え、その受容体を通じて、INS/IGF-1から始まる成長促進カスケードを開始し、筋肉量を維持します。また、このカスケードは、肝臓時計を位相同調させることもわかっています[43]。朝食でたんぱく質を摂取することは、末梢臓器の体内時計を同調させる上でも有益ということです。
糖質と同様に、脂質もまた、朝食で摂った方が、夕食で摂るよりも、中性脂肪や遊離脂肪酸が増えません。時計遺伝子のClock遺伝子が変異したマウスは、野生型対照マウスよりも、高脂肪食によって引き起こされる血清中の中性脂肪と遊離脂肪酸の増加、さらには体重増加が有意に低いことから、食事性脂肪の吸収が体内時計の影響を受けていることがわかりました[44]。マウスは、ヒトとは異なり、夜が活動期なのですが、人間に置き換えて言うなら、夕食に脂質を摂取した方が、中性脂肪と遊離脂肪酸が増えやすくなり、さらには体重も増加しやすくなるということです。
糖質も、タンパク質も、脂質も、夕食よりも朝食で摂った方が良いのですから、時間生物学的、時間栄養学的には、遅延時間制限食よりも早期時間制限食の方が好ましいという結論になるのです。それを裏付ける人間を対象とした研究結果をいくつか紹介しましょう。
- 2014年のイスラエルの研究[45]では、太った女性たちを二つのグループに分け、12週間、一方のグループに朝食重点型減量メニュー(朝食 700 kcal、昼食 500 kcal、夕食 200 kcal)を食べさせたところ、総カロリーが同じ夕食重点型減量メニュー(朝食 200 kcal、昼食 500 kcal、夕食 700 kcal)を食べたグループと比べて、体重減少、ウエスト周囲径、空腹時血糖値、インスリン、インスリン抵抗性が有意に減少したことが示されました。特に、平均中性脂肪値は、朝食重点型では33.6%減少したのに対して、夕食重点型では、14.6%増加しました。
- 2017年の米独の研究[46]では、朝食を抜いた被験者は、夕食を抜いた被験者と比較して、昼食後のグルコース濃度が有意に(p<0.05)高く、末梢血細胞の炎症も上昇したことが示されました。
- 2019年の台湾の研究[47]によると、昼食で摂取する100kcalの食事を夜食での摂取に置換すると、LDLコレステロールが1.27mg/dL(95%信用区間:2.24~0.30)高くなるのに対して、朝食で摂取する100kcalの食事を夜食での摂取に置換すると、1.46mg/dL(95%信用区間:2.42~0.50)とより高くなることが示されました。
朝食を抜く弊害を報告する研究はたくさんあります。最近発表されたメタアナリシスの結論をいくつか紹介しましょう。
- 2021年のメタアナリシス[48]によると、週3日以上朝食を抜くと、週2日以下と比較して、体重過多・肥満の相対リスクが11%(95%信用区間:4%~19%)増加することが示されました。
- 2022年のメタアナリシス[49]によると、週3日以上朝食を抜く場合の高血圧になる調整オッズ比は、1.20(95%信頼区間:1.08~1.33、P < 0.001, I2=0%)でした。
- 2022年のメタアナリシス[50]によると、朝食を抜いたことがある場合の一度もない場合と比較した2型糖尿病になる相対リスクは、BMIで調整すると、1.22(95%信用区間:1.12~1.34)でした。
- 2020年のメタアナリシス[51]によると、朝食頻度が最低のカテゴリーは、最高のカテゴリーに対して、心血管疾患の相対リスクが、1.22(95%信頼区間:1.10~1.35)、全死因死亡の相対リスクが、1.25(95%信頼区間:1.11~1.40)と有意に高くなりました。
ただし、これらは、必ずしも規則正しく行われる遅延時間制限食の弊害と同一視できないことには注意が必要です。夕食を抜く弊害を報告する研究は、朝食の場合よりもずっと少ないのですが、ないことはありません。2021年に大阪大学の学生(男子1万7573人+女子8860人)を6年間観察した後ろ向きコホート研究[52]によると、夕食を抜くことがある学生は、毎日食べる学生と比べて、体重増加の調整後発生率比が、男性で、1.42(95%信頼区間:1.02~1.98)、女性で、1.67(95%信頼区間:1.33-2.09)となり、夕食を抜くことは体重増加と関連しているというのです。
夕食を普段抜くと答えた学生は、2万人以上の中でたったの15人しかいなかったので、この研究では、しばしばあるいは時々抜くと答えた学生を含めた266人を夕食抜きのグループとしています。このグループは、他の食事を抜く頻度も高く、夜食を摂る有意な(p<0.05)傾向がみられたとのことです。つまり、このグループは、規則正しく早期時間制限食を実践していたのではなく、三食のうちどれかを抜く一方で、間食や夜食を摂ることもある不規則な食生活を送っていたということです。不規則な食生活が健康を損ねる時間生物学的メカニズムは、既に説明したとおりです。朝食抜きの弊害と言われているものも、実際には、不規則な食生活の弊害であって、これを時間制限食の弊害とみなすことはできません。
もとより、私が提案する修正早期時間制限食は、夕食を完全に抜くわけではありません。その概要は、以下のようなものです。
- 摂取カロリーが、朝食/昼食>夕食となるようにし、かつ、一日全体を減量します。
- 朝食と昼食は6時間空け、昼食から朝食までの空腹時間が18時間になるようにします。
- 夕食の量を減らして、最終的に絶食模倣食で置き換えます。
通常の早期時間制限食では、制限時間(例えば、午前8時から午後3時までの時間)内ではいくらたくさん食べてもよいとされます。そうした提案がなされるのは、一日全体の摂取カロリーを減らさなくても、早期時間制限食に代謝改善効果があるからです。
2018年のランダム化比較試験[53]は、糖尿病予備軍の男性8人を無作為に二つに分け、対照群には、午前7時から午後7時までの12時間に三食を食べさせ、処置群には、午前7時から午後1時までの6時間に同じ三食を5週間食べさせました。7週間の間隔をあけて、被験者を前回と逆の群に入れて同じ実験を反復しました。その結果、早期時間制限食は、体重減少とは独立して、インスリン感受性、インスリン抵抗性(膵臓ランゲルハンス島β細胞反応性)、拡張期血圧、収縮期血圧、酸化ストレス(8-イソプロスタンの血漿レベル)を改善したとのことです。
このランダム化比較試験は、早期時間制限食が体重減少とは独立に代謝を改善することを示すためにデザインされており、実際にダイエットする時に三食を制限時間内に押し込める必要はありません。摂取カロリーが、朝食>昼食>夕食となるようにすれば、通常、一日全体の摂取カロリーは、それ以前よりも減るはずです。そこで、私が提案する修正早期時間制限食は、一種のカロリー制限ということになりますが、通常のカロリー制限以上のメリットがあります。
健康な男性を対象に、2週間の早期時間制限食の効果をカロリー制限食の効果との比較で調べた2020年の研究[54]によると、早期時間制限食は、減量結果に有意差がなかったのにもかかわらず、インスリン感受性、骨格筋のブドウ糖と分岐鎖アミノ酸の吸収をカロリー制限食以上に有意に高めたとのことです。骨格筋がより多くのブドウ糖と分岐鎖アミノ酸を吸収したということは、それだけ筋肉量の低下が防げたということです。
早期時間制限食に対する研究はまだ始まったばかりで、ランダム化比較試験の数もまだ少数で、質の高いメタアナリシスはまだ不可能です。しかし、今のところ、同じ減量効果を持つ均等なカロリー制限よりも、体内時計の周期性をうまく利用したメリハリがあるカロリー制限の方が、健康に与える効果は高いと言えそうです。
3.3. 絶食模倣食には何が良いか
絶食模倣食とは、「断食で入ったメタボリック・スイッチとサーチュイン・スイッチを切らない食品」だということは既に述べました。メタボリック・スイッチを切らないようにするには低糖質でなければならず、サーチュイン・スイッチを切らないようにするには低カロリーかつ低タンパク質でなければいけません。また、胆嚢結石を防ぐためには、最低10gの脂質を含む必要があります。そうした観点から、いくつか有力な候補を上げたいと思います。
(1)MCTオイル
ケトン体代謝をグルコース代謝に戻さない低糖質の食品という点で、まず候補に挙がるのが、MCT(Medium Chain Triglyceride 中鎖脂肪酸)オイルです。中鎖脂肪酸は、長鎖脂肪酸よりもケトン体に変換されやすいので、MCTオイルは、ケトジェニック・ダイエット用の絶食模倣食として重宝されています。ただし、MCTオイルを購入するにあたっては、その成分に注意する必要があります。C10のデカン酸(慣用名:カプリン酸)よりもC8のオクタン酸(慣用名:カプリル酸)の方がケトン体に変換されやすいので、カプリル酸が100%近いMCTオイルを選ぶとよいでしょう。
糖質制限ブームで、MCTオイルが売れるようになりましたが、多くの人は、たんに普段の食事にMCTオイルをかけるだけでなんらかの健康効果を得られると勘違いしています。しかし、飽食中に摂取したMCTオイルは、脂肪として蓄えられる可能性があります。これに対して、空腹もしくは糖質制限を実行している時に絶食模倣食として摂取されるカプリル酸は、ケトン体の材料として速やかに代謝されるので、本来の目的を達成できます[55]。
(2)ピーナッツ
ピーナッツの成分は、半分が脂肪で、糖質やタンパク質が比較的少ないので、絶食模倣食に適しています。ビタミン、ミネラル、抗酸化物質、食物繊維を豊富に含み、健康に良いことはよく知られています。しかし、サーチュイン・スイッチを入れるという点で注目すべき特質は、ニコチン酸(nicotinic acid)を豊富に含むところにあります。以下の図に示されている通り、ニコチン酸(Na)は体内で NAD+になります。
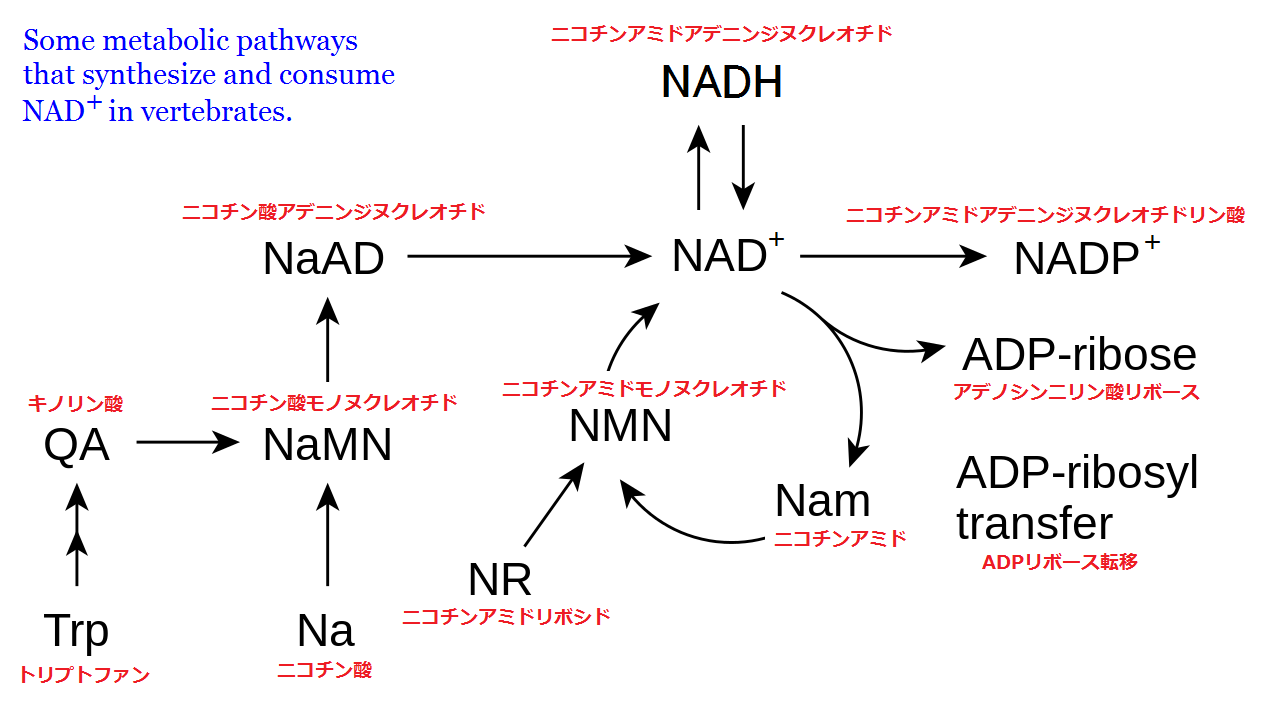
脊椎動物体内における NAD+の生成と利用の経路[56]
(3)亜麻仁油
亜麻仁油は、必須脂肪酸のω-3系のα-リノレン酸と、ω-6系のリノール酸を含みます。私たちの体は、α-リノレン酸から、IPA(イコサペンタエン酸)、さらにはDHA(ドコサヘキサエン酸)を作り出し、リノール酸からはアラキドン酸を作り出します。どれも必要ですが、不飽和脂肪酸の摂取は、とかくω-6系に偏りがちです。その点、亜麻仁油の約60%はα-リノレン酸なので、亜麻仁油は、不飽和脂肪酸の摂取の偏りを是正してくれます。えごま油の方が、α-リノレン酸を少し多く含むものの、値段が高いので、亜麻仁油の方が経済的です。1日の摂取の目安は、4~8g程度です。マウスを用いた2017年の実験[57]の結果から、ω-3系多価不飽和脂肪酸であるエイコサペンタエン酸とドコサヘキサエン酸は、サーチュイン遺伝子(SIRT1)を活性化させ、オートファジーを誘導することが判明しました。2021年のマウスを用いた研究[58]によると、ω-3系の脂肪酸は、ミトコンドリアのサーチュイン遺伝子(SIRT3)をも活性化させるとのことです。亜麻仁油やえごま油の摂取も、サーチュイン・スイッチを入れる上で有益なようです。
(4)無糖炭酸水
この程度では食べた気にならないという人のために、最後に飲み物として、無糖炭酸水を追加しましょう。水に二酸化炭素を溶かしただけですから、カロリーはありません。それでも、飲むと二酸化炭素のおかげで胃袋が膨れ、何か食べたような気がします。体を騙して、もっと食べたいという欲望を抑えるための手段としては、お薦めの飲み物です。
以上は、絶食模倣食の候補であって、これらをすべて食べろということではありません。たくさん食べれば食べるほどダイエット効果はなくなります。もとより、いきなり過激なダイエットを始めることは危険です。ケトン体代謝に慣れていない人は、当初は疲労感やめまいを感じ、気分が悪くなることがあります。それゆえ、まずは夕食を少しずつ減らすことから始めた方が安全です。夕食を絶食模倣食で置き換えることに成功したなら、次は、昼食を減らすことを試すとよいでしょう。どこまで減らせるかは人によるので、少しずつ減らすことで自分の限界を見定め、自分にとっての最適解を見出してください。
3.4. 断食すべきではない場合
私が提案する修正早期時間制限食に限らず、ダイエット一般は、決して万人に推奨できるものではありません。以下の人は、断食をはじめダイエットは避けた方が賢明です。
- 発育中の子供
- 妊娠中や授乳中の女性
- 低体重者
- 70歳以上の高齢者
- 拒食症患者(摂食障害者)
- 抗糖尿病薬の使用者
- 免疫不全の人
- 認知症患者
- 肝臓・腎臓疾患その他重大な病気がある人
抗糖尿病薬を使用している糖尿病患者がダイエットすると、重篤な低血糖を惹き起こし、死に至ることもあります。もちろん、糖尿病を患っているような人は、通常の人以上にダイエットの必要があるのですが、ダイエットする場合は、主治医の指導を受けて、行ってください。
4. 動画による要点のまとめ
5. 参照情報
- ↑ Yang, Fan, Can Liu, Xu Liu, Xiandu Pan, Xinye Li, Li Tian, Jiahao Sun, et al. “Effect of Epidemic Intermittent Fasting on Cardiometabolic Risk Factors: A Systematic Review and Meta-Analysis of Randomized Controlled Trials.” Frontiers in Nutrition 8 (October 18, 2021): 669325.
- ↑ Enríquez Guerrero, Andrea, Ismael San Mauro Martín, Elena Garicano Vilar, and María Alicia Camina Martín. “Effectiveness of an Intermittent Fasting Diet versus Continuous Energy Restriction on Anthropometric Measurements, Body Composition and Lipid Profile in Overweight and Obese Adults: A Meta-Analysis.” European Journal of Clinical Nutrition 75, no. 7 (July 2021): 1024–39.
- ↑ Hwangbo, Dae-Sung, Hye-Yeon Lee, Leen Suleiman Abozaid, and Kyung-Jin Min. “Mechanisms of Lifespan Regulation by Calorie Restriction and Intermittent Fasting in Model Organisms.” Nutrients 12, no. 4 (April 2020): 1194.
- ↑ Anton, Stephen D., Keelin Moehl, William T. Donahoo, Krisztina Marosi, Stephanie A. Lee, Arch G. Mainous III, Christiaan Leeuwenburgh, and Mark P. Mattson. “Flipping the Metabolic Switch: Understanding and Applying the Health Benefits of Fasting.” Obesity 26, no. 2 (2018): 254–68.
- ↑ Kimura, Ikuo, Daisuke Inoue, Takeshi Maeda, Takafumi Hara, Atsuhiko Ichimura, Satoshi Miyauchi, Makio Kobayashi, Akira Hirasawa, and Gozoh Tsujimoto. “Short-Chain Fatty Acids and Ketones Directly Regulate Sympathetic Nervous System via G Protein-Coupled Receptor 41 (GPR41).” Proceedings of the National Academy of Sciences 108, no. 19 (May 10, 2011): 8030–35.
- ↑ Miyamoto, Junki, Ryuji Ohue-Kitano, Hiromi Mukouyama, Akari Nishida, Keita Watanabe, Miki Igarashi, Junichiro Irie, et al. “Ketone Body Receptor GPR43 Regulates Lipid Metabolism under Ketogenic Conditions.” Proceedings of the National Academy of Sciences 116, no. 47 (November 19, 2019): 23813–21.
- ↑ Kolb, Hubert, Kerstin Kempf, Martin Röhling, Martina Lenzen-Schulte, Nanette C. Schloot, and Stephan Martin. “Ketone Bodies: From Enemy to Friend and Guardian Angel.” BMC Medicine 19, no. 1 (December 9, 2021): 313.
- ↑ Yoon, D. S., Y. Choi, and J. W. Lee. “Cellular Localization of NRF2 Determines the Self-Renewal and Osteogenic Differentiation Potential of Human MSCs via the P53-SIRT1 Axis.” Cell Death & Disease 7 (February 2016): e2093.
- ↑ Tim Vickers. “Simplified diagram of catabolism of proteins, carbohydrates and fats.” Licensed under CC-0 and modified by me.
- ↑ Fvasconcellos. “Reduction and oxidation of the coenzyme NAD.” Licensed under CC-0 and modified by me.
- ↑ Kaeberlein, Matt, Mitch McVey, and Leonard Guarente. “The SIR2/3/4 Complex and SIR2 Alone Promote Longevity in Saccharomyces Cerevisiae by Two Different Mechanisms.” Genes & Development 13, no. 19 (October 1, 1999): 2570–80.
- ↑ Salminen, Antero, and Kai Kaarniranta. “Regulation of the Aging Process by Autophagy.” Trends in Molecular Medicine 15, no. 5 (May 1, 2009): 217–24.
- ↑ Ouchi, Noriyuki, Rei Shibata, and Kenneth Walsh. “AMP-Activated Protein Kinase Signaling Stimulates VEGF Expression and Angiogenesis in Skeletal Muscle.” Circulation Research 96, no. 8 (April 29, 2005): 838–46.
- ↑ Sardeli, Amanda V., Tiemy R. Komatsu, Marcelo A. Mori, Arthur F. Gáspari, and Mara Patrícia T. Chacon-Mikahil. “Resistance Training Prevents Muscle Loss Induced by Caloric Restriction in Obese Elderly Individuals: A Systematic Review and Meta-Analysis.” Nutrients 10, no. 4 (April 2018): 423.
- ↑ Weiss, Edward P., Susan B. Racette, Dennis T. Villareal, Luigi Fontana, Karen Steger-May, Kenneth B. Schechtman, Samuel Klein, Ali A. Ehsani, John O. Holloszy, and Washington University School of Medicine CALERIE Group. “Lower Extremity Muscle Size and Strength and Aerobic Capacity Decrease with Caloric Restriction but Not with Exercise-Induced Weight Loss.” Journal of Applied Physiology (Bethesda, Md.: 1985) 102, no. 2 (February 2007): 634–40.
- ↑ Soltani, S., G. R. Hunter, A. Kazemi, and S. Shab-Bidar. “The Effects of Weight Loss Approaches on Bone Mineral Density in Adults: A Systematic Review and Meta-Analysis of Randomized Controlled Trials.” Osteoporosis International 27, no. 9 (September 1, 2016): 2655–71.
- ↑ Ling, Wen, Kimberly Krager, Kimberly K. Richardson, Aaron D. Warren, Filipa Ponte, Nukhet Aykin-Burns, Stavros C. Manolagas, Maria Almeida, and Ha-Neui Kim. “Mitochondrial Sirt3 Contributes to the Bone Loss Caused by Aging or Estrogen Deficiency.” JCI Insight 6, no. 10 (May 24, 2021): e146728.
- ↑ Veronese, Nicola, and Jean-Yves Reginster. “The Effects of Calorie Restriction, Intermittent Fasting and Vegetarian Diets on Bone Health.” Aging Clinical and Experimental Research 31, no. 6 (June 1, 2019): 753–58.
- ↑ Xu, Xiaolin, Jianyang Ding, Xiuhua Wu, Zucheng Huang, Ganggang Kong, Qi Liu, Zhou Yang, Zhiping Huang, and Qingan Zhu. “Bone Microstructure and Metabolism Changes under the Combined Intervention of Ketogenic Diet with Intermittent Fasting: An in Vivo Study of Rats.” Experimental Animals 68, no. 3 (2019): 371–80.
- ↑ Harris, Leanne, Sharon Hamilton, Liane B. Azevedo, Joan Olajide, Caroline De Brún, Gillian Waller, Vicki Whittaker, et al. “Intermittent Fasting Interventions for Treatment of Overweight and Obesity in Adults: A Systematic Review and Meta-Analysis.” JBI Evidence Synthesis 16, no. 2 (February 2018): 507–47.
- ↑ Keenan, Stephen, Matthew B. Cooke, and Regina Belski. “The Effects of Intermittent Fasting Combined with Resistance Training on Lean Body Mass: A Systematic Review of Human Studies.” Nutrients 12, no. 8 (August 2020): 2349.
- ↑ Sardeli, Amanda V., Tiemy R. Komatsu, Marcelo A. Mori, Arthur F. Gáspari, and Mara Patrícia T. Chacon-Mikahil. “Resistance Training Prevents Muscle Loss Induced by Caloric Restriction in Obese Elderly Individuals: A Systematic Review and Meta-Analysis.” Nutrients 10, no. 4 (April 2018): 423.
- ↑ Moon, Shinje, Jiseung Kang, Sang Hyun Kim, Hye Soo Chung, Yoon Jung Kim, Jae Myung Yu, Sung Tae Cho, Chang-Myung Oh, and Tae Kim. “Beneficial Effects of Time-Restricted Eating on Metabolic Diseases: A Systemic Review and Meta-Analysis.” Nutrients 12, no. 5 (May 2020): 1267.
- ↑ Chen, Jie-Hua, Louise Weiwei Lu, Qian Ge, Dana Feng, Jianfeng Yu, Bin Liu, Ruijie Zhang, Xinying Zhang, Caiqun Ouyang, and Feng Chen. “Missing puzzle pieces of time-restricted-eating (TRE) as a long-term weight-loss strategy in overweight and obese people? A systematic review and meta-analysis of randomized controlled trials.” Critical Reviews in Food Science and Nutrition (2021): 1-17.
- ↑ Fontana, Luigi, Edward P. Weiss, Dennis T. Villareal, Samuel Klein, and John O. Holloszy. “Long-Term Effects of Calorie or Protein Restriction on Serum IGF-1 and IGFBP-3 Concentration in Humans.” Aging Cell 7, no. 5 (2008): 681–87.
- ↑ Levine, Morgan E., Jorge A. Suarez, Sebastian Brandhorst, Priya Balasubramanian, Chia-Wei Cheng, Federica Madia, Luigi Fontana, et al. “Low Protein Intake Is Associated with a Major Reduction in IGF-1, Cancer, and Overall Mortality in the 65 and Younger but Not Older Population.” Cell Metabolism 19, no. 3 (March 4, 2014): 407–17.
- ↑ Rahmani, Jamal, Hamed Kord Varkaneh, Cain Clark, Hamid Zand, Hiba Bawadi, Paul M. Ryan, Somaye Fatahi, and Yong Zhang. “The Influence of Fasting and Energy Restricting Diets on IGF-1 Levels in Humans: A Systematic Review and Meta-Analysis.” Ageing Research Reviews 53 (August 1, 2019): 100910.
- ↑ Pixelsquid. “Digestive system diagram showing bile duct location.” Licensed under CC-0. 著者による加筆あり。
- ↑ Sichieri, R, J E Everhart, and H Roth. “A Prospective Study of Hospitalization with Gallstone Disease among Women: Role of Dietary Factors, Fasting Period, and Dieting.” American Journal of Public Health 81, no. 7 (July 1991): 880–84.
- ↑ Ryu, Seungho, Yoosoo Chang, Kyung Eun Yun, Hyun-Suk Jung, Jun Ho Shin, and Hocheol Shin. “Gallstones and the Risk of Gallbladder Cancer Mortality: A Cohort Study.” Official Journal of the American College of Gastroenterology ACG 111, no. 10 (October 2016): 1476–1487.
- ↑ Fan, Yonggang, Jie Hu, Bing Feng, Wei Wang, Guoliang Yao, Jingming Zhai, and Xin Li. “Increased Risk of Pancreatic Cancer Related to Gallstones and Cholecystectomy: A Systematic Review and Meta-Analysis.” Pancreas 45, no. 4 (April 2016): 503–509.
- ↑ Gebhard, R L, W F Prigge, H J Ansel, L Schlasner, S R Ketover, D Sande, K Holtmeier, and F J Peterson. “The Role of Gallbladder Emptying in Gallstone Formation during Diet-Induced Rapid Weight Loss.” Hepatology 24, no. 3 (1996): 544–48.
- ↑ Moro, Tatiana, Grant Tinsley, Antonino Bianco, Giuseppe Marcolin, Quirico Francesco Pacelli, Giuseppe Battaglia, Antonio Palma, Paulo Gentil, Marco Neri, and Antonio Paoli. “Effects of Eight Weeks of Time-Restricted Feeding (16/8) on Basal Metabolism, Maximal Strength, Body Composition, Inflammation, and Cardiovascular Risk Factors in Resistance-Trained Males.” Journal of Translational Medicine 14, no. 1 (October 13, 2016): 290.
- ↑ Araujo, Andre B., Julia M. Dixon, Elizabeth A. Suarez, M. Hassan Murad, Lin T. Guey, and Gary A. Wittert. “Endogenous Testosterone and Mortality in Men: A Systematic Review and Meta-Analysis.” The Journal of Clinical Endocrinology & Metabolism 96, no. 10 (October 1, 2011): 3007–19.
- ↑ Stratton, Matthew T., Grant M. Tinsley, Michaela G. Alesi, Garrett M. Hester, Alex A. Olmos, Paul R. Serafini, Andrew S. Modjeski, et al. “Four Weeks of Time-Restricted Feeding Combined with Resistance Training Does Not Differentially Influence Measures of Body Composition, Muscle Performance, Resting Energy Expenditure, and Blood Biomarkers.” Nutrients 12, no. 4 (April 2020): 1126.
- ↑ Martens, Christopher R., Matthew J. Rossman, Melissa R. Mazzo, Lindsey R. Jankowski, Erzsebet E. Nagy, Blair A. Denman, James J. Richey, et al. “Short-Term Time-Restricted Feeding Is Safe and Feasible in Non-Obese Healthy Midlife and Older Adults.” GeroScience 42, no. 2 (April 1, 2020): 667–86.
- ↑ Mirmiran, Parvin, Zahra Bahadoran, Zahra Gaeini, Nazanin Moslehi, and Fereidoun Azizi. “Effects of Ramadan Intermittent Fasting on Lipid and Lipoprotein Parameters: An Updated Meta-Analysis.” Nutrition, Metabolism and Cardiovascular Diseases 29, no. 9 (September 1, 2019): 906–15.
- ↑ Klein, S., Y. Sakurai, J. A. Romijn, and R. M. Carroll. “Progressive Alterations in Lipid and Glucose Metabolism during Short-Term Fasting in Young Adult Men.” The American Journal of Physiology 265, no. 5 Pt 1 (November 1993): E801-806.
- ↑ Aslam, Usman, Satoru Kobayashi, Qiangrong Liang, and Martin Gerdes. “Time-Dependent Differential Effects of Fasting on Cardiac Autophagy and Mitophagy.” The FASEB Journal 30, no. S1 (2016): 1015-1.
- ↑ Meessen, Emma C. E., Håvard Andresen, Thomas van Barneveld, Anne van Riel, Egil I. Johansen, Anders J. Kolnes, E. Marleen Kemper, et al. “Differential Effects of One Meal per Day in the Evening on Metabolic Health and Physical Performance in Lean Individuals.” Frontiers in Physiology 12 (2022).
- ↑ Asher, Gad, David Gatfield, Markus Stratmann, Hans Reinke, Charna Dibner, Florian Kreppel, Raul Mostoslavsky, Frederick W. Alt, and Ueli Schibler. “SIRT1 Regulates Circadian Clock Gene Expression through PER2 Deacetylation.” Cell 134, no. 2 (July 25, 2008): 317–28.
- ↑ Nakahata, Yasukazu, Saurabh Sahar, Giuseppe Astarita, Milota Kaluzova, and Paolo Sassone-Corsi. “Circadian Control of the NAD+ Salvage Pathway by CLOCK-SIRT1.” Science 324, no. 5927 (May 2009): 654–57.
- ↑ Ikeda, Yuko, Mayo Kamagata, Mizuho Hirao, Shinnosuke Yasuda, Shiho Iwami, Hiroyuki Sasaki, Miku Tsubosaka, et al. “Glucagon and/or IGF-1 Production Regulates Resetting of the Liver Circadian Clock in Response to a Protein or Amino Acid-Only Diet.” EBioMedicine 28 (February 1, 2018): 210–24.
- ↑ Oishi, Katsutaka, Gen-ichi Atsumi, Shinobu Sugiyama, Ikuko Kodomari, Manami Kasamatsu, Kazuhiko Machida, and Norio Ishida. “Disrupted Fat Absorption Attenuates Obesity Induced by a High-Fat Diet in Clock Mutant Mice.” FEBS Letters 580, no. 1 (January 9, 2006): 127–30.
- ↑ Jakubowicz, Daniela, Maayan Barnea, Julio Wainstein, and Oren Froy. “High Caloric Intake at Breakfast vs. Dinner Differentially Influences Weight Loss of Overweight and Obese Women.” Obesity 21, no. 12 (2013): 2504–12.
- ↑ Nas, Alessa, Nora Mirza, Franziska Hägele, Julia Kahlhöfer, Judith Keller, Russell Rising, Thomas A Kufer, and Anja Bosy-Westphal. “Impact of Breakfast Skipping Compared with Dinner Skipping on Regulation of Energy Balance and Metabolic Risk.” The American Journal of Clinical Nutrition 105, no. 6 (June 1, 2017): 1351–61.
- ↑ Chen, H. J., S. Y. Chuang, H. Y. Chang, and W. H. Pan. “Energy Intake at Different Times of the Day: Its Association with Elevated Total and LDL Cholesterol Levels.” Nutrition, Metabolism and Cardiovascular Diseases 29, no. 4 (April 1, 2019): 390–97.
- ↑ Wicherski, Julia, Sabrina Schlesinger, and Florian Fischer. “Association between Breakfast Skipping and Body Weight—A Systematic Review and Meta-Analysis of Observational Longitudinal Studies.” Nutrients 13, no. 1 (January 2021): 272.
- ↑ Li, Zishuo, Hongli Li, Qin Xu, and Yanli Long. “Skipping Breakfast Is Associated with Hypertension in Adults: A Meta-Analysis.” International Journal of Hypertension 2022 (March 3, 2022): e7245223.
- ↑ Ballon, Aurélie, Manuela Neuenschwander, and Sabrina Schlesinger. “Breakfast Skipping Is Associated with Increased Risk of Type 2 Diabetes among Adults: A Systematic Review and Meta-Analysis of Prospective Cohort Studies.” The Journal of Nutrition 149, no. 1 (January 1, 2019): 106–13.
- ↑ Chen, Hanze, Beidi Zhang, Yusong Ge, Han Shi, Siqi Song, Weishuang Xue, Jinwei Li, et al. “Association between Skipping Breakfast and Risk of Cardiovascular Disease and All Cause Mortality: A Meta-Analysis.” Clinical Nutrition 39, no. 10 (October 1, 2020): 2982–88.
- ↑ Yamamoto, Ryohei, Ryohei Tomi, Maki Shinzawa, Ryuichi Yoshimura, Shingo Ozaki, Kaori Nakanishi, Seiko Ide, et al. “Associations of Skipping Breakfast, Lunch, and Dinner with Weight Gain and Overweight/Obesity in University Students: A Retrospective Cohort Study.” Nutrients 13, no. 1 (January 2021): 271.
- ↑ Sutton, Elizabeth F., Robbie Beyl, Kate S. Early, William T. Cefalu, Eric Ravussin, and Courtney M. Peterson. “Early Time-Restricted Feeding Improves Insulin Sensitivity, Blood Pressure, and Oxidative Stress Even without Weight Loss in Men with Prediabetes.” Cell Metabolism 27, no. 6 (June 5, 2018): 1212-1221.e3.
- ↑ Jones, Robert, Pardeep Pabla, Joanne Mallinson, Aline Nixon, Tariq Taylor, Andrew Bennett, and Kostas Tsintzas. “Two Weeks of Early Time-Restricted Feeding (ETRF) Improves Skeletal Muscle Insulin and Anabolic Sensitivity in Healthy Men.” The American Journal of Clinical Nutrition 112, no. 4 (October 1, 2020): 1015–28.
- ↑ Norgren, Jakob, Shireen Sindi, Anna Sandebring-Matton, Ingemar Kåreholt, Makrina Daniilidou, Ulrika Akenine, Karin Nordin, Staffan Rosenborg, Tiia Ngandu, and Miia Kivipelto. “Ketosis After Intake of Coconut Oil and Caprylic Acid—With and Without Glucose: A Cross-Over Study in Healthy Older Adults.” Frontiers in Nutrition 7 (2020).
- ↑ Fvasconcellos. “Biosynthesis and salvage pathways in NAD+ and NADP+ metabolism.” をもとに私が作成した図。
- ↑ Inoue, Takayuki, Masashi Tanaka, Shinya Masuda, Ryuji Ohue-Kitano, Hajime Yamakage, Kazuya Muranaka, Hiromichi Wada, et al. “Omega-3 Polyunsaturated Fatty Acids Suppress the Inflammatory Responses of Lipopolysaccharide-Stimulated Mouse Microglia by Activating SIRT1 Pathways.” Biochimica et Biophysica Acta (BBA) – Molecular and Cell Biology of Lipids 1862, no. 5 (May 1, 2017): 552–60.
- ↑ Son, Sung Hyun, Su Mi Lee, Mi Hwa Lee, Young Ki Son, Seong Eun Kim, and Won Suk An. “Omega-3 Fatty Acids Upregulate SIRT1/3, Activate PGC-1α via Deacetylation, and Induce Nrf1 Production in 5/6 Nephrectomy Rat Model.” Marine Drugs 19, no. 4 (March 2021): 182.


コメント