前回、断続的断食によって抗老化カスケードを活性化させ、寿命を延ばす方法を提案しました。しかし、みなさんの中には、断食やカロリー制限はつらいからやりたくないとか、仕事柄、会食を避けられないとかという人もいることでしょう。そういう人のために、断食やカロリー制限なしでも、食べることで同じような効果をもたらすカロリー制限模倣物質の研究が進んでいます。カロリー制限模倣物質の候補はたくさんあるのですが、今回は、その中でも代表的なカロリー制限模倣物質を含み、かつ簡単に入手できる食物を紹介したいと思います。
1. 医薬品で寿命を延ばせるか
カロリー制限は、現時点において、科学的に実証された唯一の寿命延長方法です。しかし、空腹に耐えながらカロリー制限を長期にわたって続けることは、多くの人にとって困難です。そこで、カロリー制限なしで同様の効果を発揮するカロリー制限模倣物質の探求が始まりました。この章では、最も効果的なカロリー制限模倣薬を見つけようとする医療界の動向を概観します。
1.1. カロリー制限模倣薬の発見と研究
最初にカロリー制限模倣薬として提案されたのは、解糖抑制のある抗がん剤、2-デオキシ-D-グルコース(2-Deoxy-d-glucose)で、1998年のことです[1]。この薬は、グルコース不足をもたらすことでカロリー制限と同様の効果を生むのですが、ラットを用いた実験で心毒性が指摘され、それを避けるために、低用量でしか使えません。
その後、グリコシダーゼを阻害する抗糖尿病薬、アカルボース(Acarbose)やグルコース排泄作用のある抗糖尿病薬、SGLT2阻害薬に、2-デオキシ-D-グルコースと同様の効能が認められるようになりました。これらの薬は、
カロリー制限 → グルコース不足 → Sirt1/AMPKの活性化 → 抗老化カスケードの発現と成長促進カスケードの抑制
という経路における「グルコース不足」のような上流のイベントを模倣することから、上流型(Upstream-type)と呼ばれています[2]。これに対して、「Sirt1/AMPKの活性化」あるいは「抗老化カスケードの発現と成長促進カスケードの抑制」という下流のイベントを模倣する薬は、下流型(Downstream-type)と呼ばれます。
下流型の代表的なカロリー制限模倣薬は、AMPKを活性化して、抗老化カスケードを発現する抗糖尿病薬のメトホルミン(Metformin)とmTORを阻害して、成長促進カスケードを抑制する免疫抑制剤のラパマイシン(Rapamycin)です。ラパマイシンは、リンパ脈管筋腫症治療薬としても認可されていますが、免疫を抑制するのですから、健常人が常用すれば、免疫機能に悪影響が出ます。メトホルミンは、比較的副作用が少なく、寿命延長効果もあることから、糖尿病治療の第一選択薬になっています。では、メトホルミン以外に有望なカロリー制限模倣薬の候補はないのでしょうか。
1.2. 最も有望なカロリー制限模倣薬
米国食品医薬品局(Food and Drug Administration=FDA)承認の医薬品のうち、老化治療薬として有望なカロリー制限模倣薬をスコアで評価した論文[3]が、2022年に公表されました。そのスコアに基づく老化治療薬候補ランキングが、以下の表です。
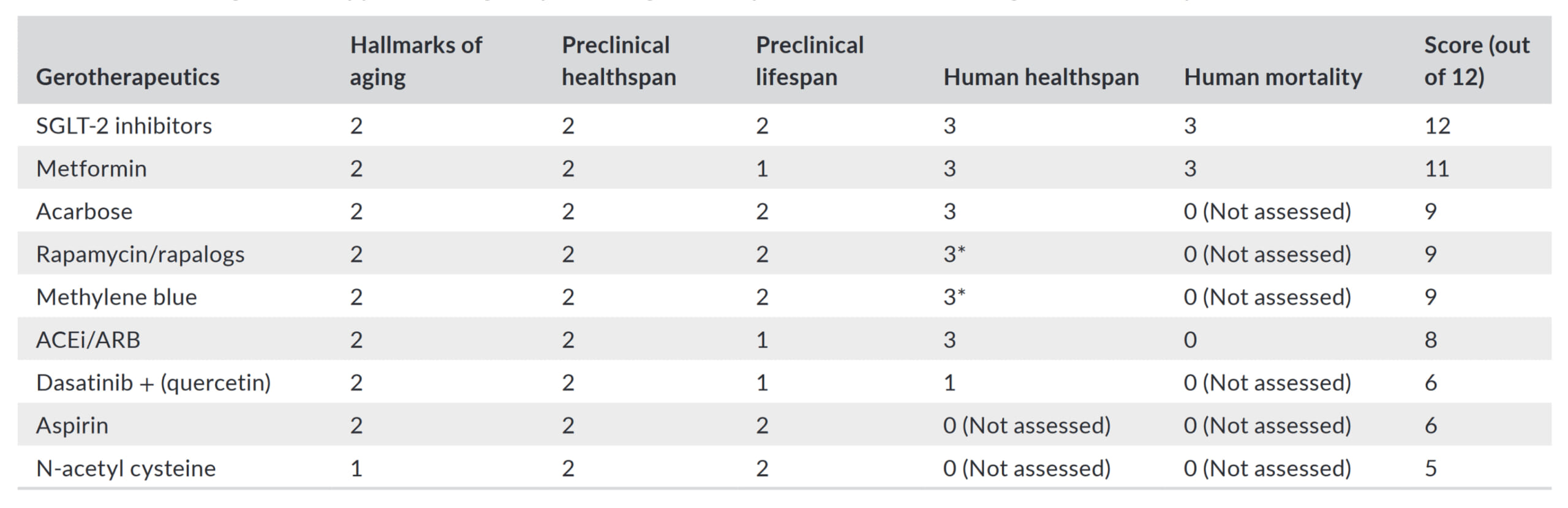
前臨床および臨床エビデンスのスコアリング(12点満点)に基づく、老化治療薬の可能性を秘めたFDA承認薬のランキング。出所:Kulkarni, Ameya S., Sandra Aleksic, David M. Berger, Felipe Sierra, George A. Kuchel, and Nir Barzilai. “Geroscience-Guided Repurposing of FDA-Approved Drugs to Target Aging: A Proposed Process and Prioritization.” Aging Cell 21, no. 4 (2022). Licensed under CC-BY.
満点でランキング1位となったのは、上流型のカロリー制限模倣薬、SGLT2阻害薬です。SGLT2阻害薬は、腎臓において糖を尿細管に再吸収させるSGLT2の働きを阻害することで、糖を尿として排泄させ、血糖値を下げる糖尿病治療です。2019年のメタアナリシス[4]によると、合計6万人以上の2型糖尿病患者を対象とした42の臨床試験から、SGLT2阻害薬投与は、有害な心血管イベントの発生を抑制し、全原因死亡率を有意に低下させることが判明しました。オッズ比は、有害な心血管イベントで、0.86(95%信用区間:0.80 ~ 0.93, P<0.0001)、全原因死亡率で、0.85(95%信用区間:0.79 ~ 0.92, P<0.0001)でした。
ランキング2位となったのは、下流型のカロリー制限模倣薬、メトホルミンです。スコアがSGLT2阻害薬より低くなったのは、否定的な結果が出た動物実験があったからにすぎず、ヒトに関しては、SGLT2阻害薬に勝るとも劣らぬ結果を出しています。2019年の別のメタアナリシス[5]によると、合計100万人以上の患者を対象とした40の臨床試験から、メトホルミン投与は、心疾患患者の心血管死亡率と全原因死亡率を有意に低下させることが判明しました。調整ハザード比は、心血管死亡率で、0.81(95%信頼区間:0.79 ~ 0.84, P<0.00001)、全原因死亡率で、0.67(95%信用区間:0.60 ~ 0.75, P<0.00001)でした。メトホルミンは、たんに糖尿病や心疾患の改善に役立つだけでなく、がん[6]、パーキンソン病[7]、アルツハイマー病[8]、自己免疫性炎症性疾患[9]など、加齢とともに増加する傾向がある様々な疾患の予防と改善に役立つ可能性が指摘されています。このため、多くの人からカロリー制限模倣薬候補の最右翼と目されています。
1.3. 老化治療薬はいつ認可されるか
現在、カロリー制限模倣薬として最も有望なのは、メトホルミンとSGLT2阻害薬だと言えます。それなら、寿命を延ばすために、今からメトホルミンやSGLT2阻害薬を服用しようと思う人もいるかもしれません。しかし、メトホルミンやSGLT2阻害薬が、糖尿病をはじめとする疾患のある患者の寿命を延ばすとしても、そうした疾患を持たない健常者の寿命まで延ばすのかどうかはまだわからないし、懐疑的な意見[10]もあります。
しかも、これらは医薬品として扱われるだけあって、使い方を誤れば、重大な副作用を惹き起こす可能性があります。例えば、メトホルミンには、下痢、悪心、食欲不振、腹痛などの副作用があり、特に腎機能低下時や脱水時にメトホルミンを服用すると、乳酸アシドーシスにより死に至る場合があります。また、長期にわたって服用すると、ビタミンB12欠乏症になる可能性もあります。SGLT2阻害薬の場合、尿路・性器感染症に加え、重症低血糖、ケトアシドーシス、脳梗塞、全身性皮疹などの重篤な副作用も報告されており、安易な使用は禁物です。
将来、老化が病気と認定され、メトホルミンなどのカロリー制限模倣薬が老化治療薬として処方される時代が来るかもしれません。実際、米国では、ニル・バルジライたちが、65歳から79歳までの三千人以上を対象にメトホルミンの抗老化作用を調べる6年間の全米規模の臨床試験をTAME(Targeting Aging with Metformin)試験の名のもとに実施しています[11]。しかし、老化治療薬として認可されるかどうかは不確定ですし、日本でどうなるかもわかりません。そもそも、日本でも、米国でも、老化はまだ病気と認定されていません。
石橋を叩いて渡る行政の遅い対応に付き合っていられないという人には、医薬品よりも安全なカロリー制限模倣物質を今から摂取するという手があります。先ほど紹介した老化治療薬候補ランキングは、FDA承認の医薬品に候補を限定していて、一般食物やサプリメント(栄養補助食品)を候補から除外しています。しかし、一般食物やサプリメントの中にも、カロリー制限模倣物質はあり、かつ、その多くは安全に摂取できます。そこで、次に、サプリメントで有望な候補がないのかを考えましょう。
2. サプリメントで寿命を延ばせるか
食物に含まれるカロリー制限模倣物質の中で、最も有名で、最も研究されているのが、レスベラトロールです。レスベラトロールのサプリメントは、かなり前から販売され、今でもアンチ・エイジングを求める多くの人が服用しています。最近では、レスベラトロールの生体利用率を高めたレスベラトロールの類縁体、プテロスチルベンが注目され、こちらもサプリメントとして販売されるようになりました。この章では、これらのサプリメントを服用すべきかどうかを考えます。
2.1. レスベラトロールのカロリー制限模倣効果
レスベラトロール(Resveratrol)は、1939年に北海道帝国大学の高岡道夫が発見したポリフェノールの一種です。レゾルシノール(Resorcinol)構造を持つバイケイソウ(Veratrum album)の成分という意味で、レスベラトロールと命名されました。1988年にはブドウの果皮に、1992年にはワインにもレスベラトロールが含まれることがわかりました。
レスベラトロールが世間から注目されるようになったきっかけは、フレンチ・パラドックスです。1992年に、フランス人は、肉やフォアグラなど脂肪たっぷりの食事を摂っているのにもかかわらず、冠動脈性心疾患による死亡率が低い(平均寿命も比較的高い)という逆説が指摘され、フレンチ・パラドックスと名付けられました[12]。このパラドックスを説明する鍵は、他国よりもはるかに多いフランスでのワインの消費にあると当初から考えられていました。統計を疑う人もいましたが、統計に本質的な問題があるわけではなく、2020年の最近の研究[13] でも、ワインに含まれる微量成分に原因が求められています。

フランス料理
ワインの微量成分の主な種類は、フラバノール(カテキン、エピカテキンなど)、フラボノール(ケルセチン、ケンペロールなど)、アントシアニン(マルビジン-3-グルコシドなど)、スチルベノイド(レスベラトロールなど)、フェノール酸(クマル酸、桂皮酸、カフェ酸、ゲンチジン酸、フェルラ酸、バニリン酸)です。こうした微量成分の大部分は、他の食材にも多く含まれています。そこで、ブドウの果皮に特に多いのに、他の食材(ピーナッツやリンゴの皮、ベリー類やザクロ)にはわずかしか含まれていないレスベラトロールが注目されるようになったのです。
では、レスベラトロールには、本当に不摂生なフランス人の長寿を説明するほどの抗老化作用がヒトに対してあるのでしょうか。最近発表された二つのメタアナリシスの結果を紹介しましょう。
- 2018年のメタアナリシス[14]によると、レスベラトロール投与群の対照群と比較した標準化平均差は、体重で、-0.17(95%信用区間:-0.33 ~ -0.01, P=0.03)、脂肪量で、-0.32(95%信用区間:-0.62 ~ -0.03, P=0.03)、除脂肪量で、1.21(95%信用区間:0.75 ~ 1.67, P<0.001)でした。つまり、レスベラトロールは、体重や脂肪量は減らすものの、脂肪以外の筋肉量などは逆に増やしたということです。レプチンやアディポネクチン値に有意な変化はありませんでした。
- 2019年のメタアナリシス[15]によると、レスベラトロールを10週間以上500mg以上投与した処置群の対照群と比較した標準化平均差は、グルコースのレベルで、-1.73(95%信用区間:-2.99 ~ -0.47, p=0.007)、腹囲で、-1.73(95%信用区間:-2.79 ~ -0.67, p=0.001)でした。
以上から、レスベラトロールには、カロリー制限模倣物質としての一定の効果があると言えますが、他方で、レスベラトロールのラットでの生体利用率は20%程度で、ヒトでの生体利用率となると、1%未満と極めて低く[16]、よほどの高用量投与でないと効果が現れません。高用量投与でも副作用がないとはいえ、あまりにも非効率です。そこで、近年、レスベラトロールの類縁体でありながら、レスベラトロールよりも「約3~4倍生体利用率が高い[17]」プテロスチルベンが注目されています。
2.2. プテロスチルベンのカロリー制限模倣効果
プテロスチルベン(Pterostilbene)では、以下の構造式に示したとおり、レスベラトロールの二つの水酸基(-OH)がメチル化されて、メトキシ基(-OCH3)に置換されています。
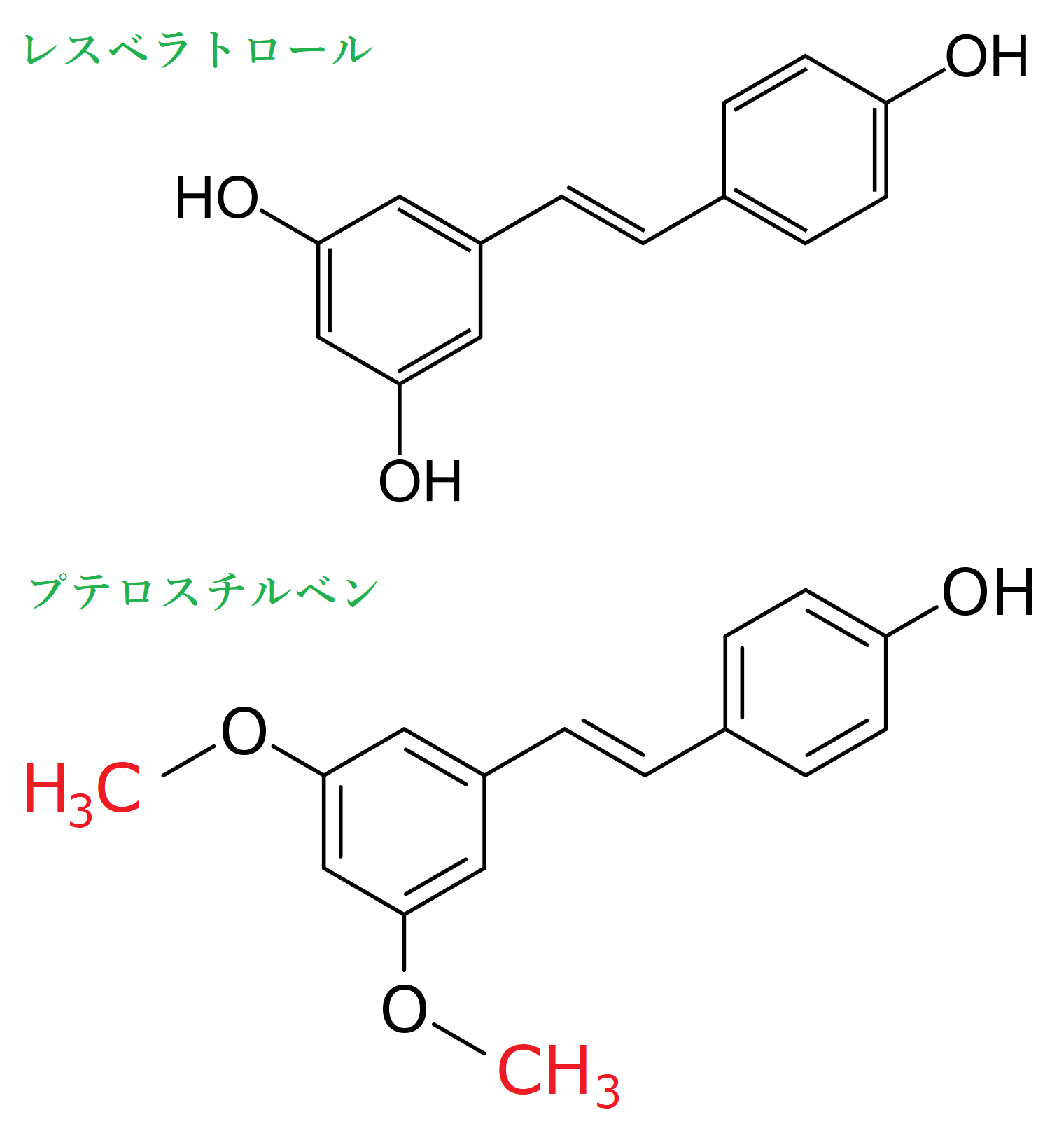
レスベラトロールとプテロスチルベンの構造式
プテロスチルベンは、メトキシ基ゆえに油に溶けやすく、そのため、レスベラトロールよりも体内に留まる時間が長く、生体利用率が高いのです。
プテロスチルベンには、レスベラトロールと同様に、カロリー制限模倣物質としての効果がありますが、この物質の作用のうち、近年特に研究者の注目を集めているのは、その抗腫瘍作用です[18]。前回使用した言葉を使うと、カロリー制限は一方で抗老化カスケードを活性化しつつ、他方で成長促進カスケードを抑制します。抗老化カスケードの活性化は、オートファジーを促進し、炎症の原因を取り除きます。成長促進カスケードの抑制は、がん細胞の成長を抑制し、アポトーシスによるがん細胞の死滅を促します。プテロスチルベンは、そうしたさまざまなシグナル伝達カスケードにより、抗腫瘍作用をもたらしていると考えられています[19]。
プテロスチルベンは、がんのような内なる異物だけでなく、細菌やウイルスのような外部から侵入する異物の増殖をも抑制します。例えば、プテロスチルベンが、Ras-cAMP経路を通じて、カンジダ菌バイオフィルムの形成を阻害し糸状菌の増殖を止めることが、ラットでの実験で示されています[20]。最近では、新型コロナウイルス(SARS-CoV-2)による感染症(COVID‑19)に効果がある可能性まで報告されています[21]。また、プテロスチルベンは、生活習慣病、がん、感染症のみならず、認知症の改善にも効果があるのではないかと考えられています[22]。
レスベラトロールも同様の抗腫瘍作用、抗細菌作用、抗ウイルス作用、認知症改善機能を持つはずですが、生体利用率が低いため、プテロスチルベンの方が低い用量で効果を発揮することが期待されています。これほど様々な病気に効果があるのなら、さっそくプテロスチルベンのサプリメントを服用しようと思う人もいるかもしれません。しかし、プテロスチルベンの効果は、まだ動物実験で確かめられている段階で、ヒトを対象としたランダム化比較試験の結果は、まだ発表されていません。ヒトに関して実証されていることは、一日250mgまでは摂取しても安全[23]ということぐらいで、どの程度の容量を摂取すれば、どのような効果があるかということに関しては、確実なことはまだ何もわかっていません。それゆえ、現時点では、サプリメントの購入を推奨しません。
2.3. 他のファイトケミカルとの相乗効果
西洋の科学には、原因を一つの要因に絞り込もうとする還元主義的傾向が伝統的にあります。フレンチ・パラドックスにおいても、科学者たちは、一種類の成分に原因があるはずだと想定して、ワインに特異的に多く含まれるレスベラトロールにスポットライトを当てました。しかし、ワインに含まれるレスベラトロールは、単独でカロリー制限模倣効果を出すには、あまりにも含有量が少なく、またあまりにも生体利用率が低いので、それだけでフレンチ・パラドックスを説明できません。むしろ、科学者が注目すべきだったワインの特異性は、他の飲み物と比べてポリフェノールを多く含むことだったのではないでしょうか。
もとより、カロリー制限模倣物質全体をカバーするには、ポリフェノールという括りでもまだ狭すぎます。実際、レスベラトロールはポリフェノールですが、プテロスチルベンはそうではありません。ポリフェノール(polyphenol)とは、その名の通り、複数(ポリ)のフェノール性水酸基を持つ化合物の総称です。プテロスチルベンでは、芳香環にヒドロキシ基が一つしか結合していないので、フェノール性水酸基を複数持っているという条件を満たしません。だからと言って、カロリー制限模倣機能が劣るということはありません。それゆえ、ポリフェノールかどうかはそれほど重要ではなく、カロリー制限模倣物質という観点から注目すべきカテゴリーは、ポリフェノールよりも包括的な概念のファイトケミカルと言うべきでしょう。
ファイトケミカル(phytochemical)とは、植物が、紫外線、低栄養、塩、乾燥、寄生者、捕食者など、様々なストレスから自分の身を守るために保持するようになった化学物質の総称です。ファイト(phyto)は、古代ギリシャ語で「植物」を意味するプフィトン(φυτόν)に由来するので、古代ギリシャ語の発音を尊重して、フィトケミカルと呼ぶこともありますが、ここでは、英語の発音で音写することにしましょう。
ファイトケミカルの中には、動物にとって毒になるものもありますが、多くは、健康に望ましい影響を与えます。これは、植物にとって動物が必ずしも敵ではないことによります。特に被子植物にとって、種子を遠くに散布してもらう上で、動物の協力が必要なため、動物を惹き付ける競争が被子植物の間で起き、その結果、動物にとって魅力的な果実が誕生しました。今日、人類は、農業を始めたことで、作物との共生関係を強化し、植物が自分の身を守るために開発したファイトケミカルを、人類の身を守るために転用できるようになりました。
ブドウもそうした作物の一つで、その果皮は、レスベラトロール以外にも、ケルセチン、ケンフェロール、カテキン、エピカテキン、アントシアニンといった多くの種類のファイトケミカル(ポリフェノール)を含有しています。これらは、単独でもカロリー制限模倣効果をもたらすものの、組み合わせて摂取することで、相乗的な効果を発揮することが、最近の研究からわかってきました。そのいくつかを紹介しましょう。
- ラットを用いた実験で、トリグリセリドリパーゼによる脂肪組織の分解に与える影響を調べたところ、ワイン成分のレスベラトロールとケルセチンをそれぞれ単独で投与しても、脂肪組織重量の有意な減少は見られませんでしたが、両分子を組み合わせて投与すると、分析したすべての脂肪層で有意な重量の減少が見られました[24]。
- ヒト培養細胞における核増殖抗原Ki67の発現で、細胞増殖を抑制する効果を調べたところ、ケルセチンとケンフェロールの組み合わせによる相乗効果は、それぞれの単独投与による相加効果よりも大きいことが確認されました[25]。ケルセチンとケンフェロールを単独で使う場合よりも、併用した方がより大きな抗腫瘍作用を生むということです。
- ヒト・ヘパトーム(HepG2-C8)で、Nrf2制御遺伝子の活性を調べたところ、ベリー成分のケルセチン、ケンフェロール、プテロスチルベンは、単独の効果よりも、併用による相乗効果の方が大きいという結果になりました[26]。これらの成分のシナジーによる抗酸化作用は、がんの化学予防に貢献する可能性があります。
要するに、単独のファイトケミカルをサプリメントで大量に摂取するよりも、複数のファイトケミカルのパッケージである果物や野菜を食べる方が、カロリー制限模倣効果が期待できるということです。そもそもカロリー制限模倣効果をもたらすシグナル伝達経路は単線的ではないので、複数のファイトケミカルが複線的にシグナル伝達する方がより確実にエピジェネティックな変化をもたらすと考えられます。
食物に含まれる個々のファイトケミカルの量はわずかですが、量を増やせばよいというものでもありません。例えば、レスベラトロールとケンフェロールとルチンの混合物には抗菌作用がありますが、その濃度を上げると相乗効果が失われるという報告[27]があります。
もしもレスベラトロールあるいはプテロスチルベン単独に顕著な健康効果があるのなら、なぜ植物は、それらの成分をもっと増やすように進化しなかったのでしょうか。植物は長い時間をかけて進化し、ファイトケミカルによってストレスから自分の身を守り、かつ動物との共生関係を築いてきました。進化の歴史において、ファイトケミカルの選別を間違った種は淘汰されたことでしょう。今生き延びている植物に含まれているファイトケミカルの集合体は、選ばれた種が選んだエリート栄養素のパッケージなのですから、それをそのまま食べる方が賢明ではないでしょうか。
3. 食物で寿命を延ばせるか
ようやく「寿命を延ばす食物は何か」という本題の問いに答える地点に到着しました。その答えは、カロリー制限模倣物質を豊富に含む食物ということです。この章では、レスベラトロールを豊富に含むブドウとプテロスチルベンを豊富に含むブルーベリーの健康効果を確認した上で、他に寿命を延ばす食物がないのかを考えます。
3.1. ブドウのカロリー制限模倣効果
フレンチ・パラドックスと赤ワインの健康効果が人口に膾炙すると、ワイン消費量が倍増する空前の赤ワイン・ブームが、1997年から1998年にかけて日本で起きました。しかし、アルコールの消費は健康を損ねる[28]ことがわかっているので、健康効果を求めるなら、ワインを飲むよりも、ワインの材料であるブドウを食べるべきです。

ブドウの房
既に述べたように、ブドウは、レスベラトロール、ケルセチン、ケンフェロール、カテキン、エピカテキン、アントシアニンなど、ファイトケミカルが豊富で、それらの相乗効果により、抗老化カスケードが活性化されるはずです。そのことをランダム化比較試験の結果で確認しましょう。
合計618人の被験者からなる24のランダム化比較試験をまとめた2020年のメタアナリシス[29]によると、プラセボを摂取した対照群と比較したブドウ摂取者群の平均差は、
- 総コレステロールで、-7.6 mg/dL(95%信用区間:-10.8 ~ -4.4, p < 0.001)
- HDLコレステロールで、1.4 mg/dL(95%信用区間:0.8 ~ 1.9, p < 0.001)
- LDLコレステロールで、-6.3 mg/dL(95%信用区間:-9.5 ~ -3.0, p < 0.001)
- 酸化LDLコレステロールで、-4.5 U/L(95%信用区間:-7.5 ~ -1.5, p = 0.003)
- アポリポタンパク質Bで、-2.4 mg/dL(95%信用区間:-4.5 ~ -0.3, p = 0.026)
- 中性脂肪で、-14.5 mg/dL(95%信用区間:-17.7 ~ -11.2, p < 0.001)
でした。また、合計1344人の被験者からなる28のランダム化比較試験をまとめた2021年のメタアナリシス[30]によると、プラセボを摂取した対照群と比較したブドウ摂取者群の加重平均差は、
- 収縮期血圧で、-3.40 mmHg(95%信用区間:-6.55 ~ -0.24, p = 0.03)
- 拡張期血圧で、-1.69 mmHg(95%信用区間:-3.12 ~ -0.27, p = 0.01)
でした。ブドウにこうした効果があるのなら、フレンチ・パラドックスをワインで説明しようとした1992年の仮説は見当違いとは言えないでしょう。
日本では、皮をむいてブドウを食べる人が多いのですが、ブドウの栄養は実よりも皮に多く含まれるので、皮ごと食べる方がお薦めです。赤ワインに健康効果があるのも、果汁だけでなく皮や種も一緒に発酵させているからです。皮ごと食べられる種なしブドウが最近では安価に輸入されるようになったので、丸ごと食べることが難しくなくなりました。そうしたブドウは、海外で一般的なように、丸ごと食べましょう。
3.2. ブルーベリーのカロリー制限模倣効果
プテロスチルベンの生体利用率がレスベラトロールよりも高いのなら、プテロスチルベンを豊富に含む食物は、ブドウよりもより大きなカロリー制限模倣効果が期待できると思うかもしれません。プテロスチルベンを豊富に含む代表的な食物は、ブルーベリーですが、豊富に含むと言っても、あくまでも他の食材と比べてのことです。プテロスチルベンの含有率は、ブルベリーの種類にもよりますが、1グラムにつき、99ng~520ng[31]です。ng(ナノグラム)は、10億分の1グラムですから、非常にわずかです。

ブルーベリー
それでも、ブルベリーは、ケルセチン(1138.4ng/mL)やケンフェロール(466.38ng/mL)[32]などカロリー制限模倣効果が知られている他のファイトケミカルを含んでいて、これらが抗酸化作用を発揮する上で相乗効果があることは、既に確認したところです。
では、ブルーベリーのカロリー制限模倣効果はどの程度のものなのでしょうか。2021年のシステマティック・レビューとメタアナリシス[33]によると、ブルーベリー投与は、
- 総コレステロールで、-0.2204 mmol/L(95%信用区間:-0.3966 ~ -0.0443, p = 0.0142)
- LDLコレステロールで、-0.2406 mmol/L(95%信用区間:-0.3784 ~ -0.1027, p = 0.0006)
- 拡張期血圧で、-2.0165 mm Hg(95%信用区間:-3.8399, -0.1931 p = 0.0302)
の有意差をもたらしましたが、HDLコレステロール、中性脂肪、収縮期血圧に有意差をもたらしませんでした。ブドウと投与量が同じではないので、単純な比較はできませんが、生活習慣病予防という点ではブドウほどではないという印象を受けます。それでも、ブルーベリーのファイトケミカルには、抗腫瘍作用[34]も期待されていて、決して食べて無駄な果物ではありません。
多くの人は、ブルーベリーをブルーベリー・ジャムとして摂取していますが、ジャムには砂糖をはじめ余計な添加物がたくさん含まれているので、それよりは、添加物が何も入っていない冷凍ブルーベリーをヨーグルト、オートミール、シリアルなどに加えて食べる方が、健康という観点からはお薦めです。
ブルーベリーは無農薬で栽培できますが、海外から輸入される冷凍ブルーベリーには農薬が含まれる場合があります。2013年に、カナダ産冷凍ブルーベリーから残留農薬基準を超えるビフェントリンが検出され、回収されるという出来事がありました[35]。市中に出回っている冷凍ブルーベリーは、収穫後洗浄され、基準を満たして安全なはずですが、心配なら、食べる前に水洗いをすればよいでしょう。また、ブルーベリーは、素人でも比較的簡単に栽培できるので、家庭菜園が趣味の方には、自宅で育てて食べるという手もあります。

ブルーベリーの灌木
3.3. その他の食物のカロリー制限模倣効果
カロリー制限模倣物質として機能するファイトケミカルを豊富に含む果物や野菜は他にもたくさんあります。そこで、次にケルセチンを多く含む食材を取り上げましょう。ケルセチンは、レスベラトロールやプテロスチルベンと同様に、単独でサプリメントとしても販売されている人気のファイトケミカルです。
ケルセチンは単独で血圧を下げる効果があります。合計896人の被験者からなる17のランダム化比較試験をまとめた2020年のメタアナリシス[36]によると、プラセボを摂取した対照群と比較したケルセチン摂取者群の加重平均差は、
- 収縮期血圧で、-3.09 mmHg(95%信用区間:-4.59 ~ -1.59, p = 0.0001)
- 拡張期血圧で、-2.86 mmHg(95%信用区間:-5.09 ~ -0.63, p = 0.01)
でした。ケルセチンをはじめとする多くのファイトケミカルを含むブドウとほぼ同じ降圧効果です。
ケルセチンを多く含有する代表的な食材はタマネギです。タマネギのケルセチン・グルコシドは、赤ワインのケルセチン・グルコシドあるいケルセチン・ルチノシドよりも腸管吸収性が高い[37]ので、特にケルセチンを摂りたいのなら、タマネギが最適です。

タマネギ
では、タマネギを食べる効果はどうでしょうか。合計446人の被験者からなる10のランダム化比較試験をまとめた2021年のメタアナリシス[38]によると、プラセボを摂取した対照群と比較したタマネギ摂取者群の平均差は、
- 総コレステロールで、-5.39 mg/dL(95%信用区間:-10.68 ~ -0.09, I2 = 49%)
- HDLコレステロールで、2.29 mg/dl(95%信用区間:0.87 ~ 3.72, I2 = 0%)
- LDLコレステロールで、-6.64 mg/dl(95%信用区間:-10.91 ~ -2.36, I2 = 32%)
- 中性脂肪で、-6.55 mg/dL(95%信用区間:-15.64 ~ 2.53, I2 = 45%)
でした。ブドウと比べても遜色のない結果です。
野菜や果物が健康に良いのは常識だと言う人もいるでしょうが、健康に良い理由まで説明できる人は少ないのではないでしょうか。野菜や果物は、食物繊維が豊富なので、腸内環境の改善を通じて寿命を延ばすといった他の理由を否定するつもりはありませんが、野菜や果物が含むファイトケミカルがカロリー制限模倣物質として機能し、抗老化カスケードの発現と成長促進カスケードの抑制とをもたらすことが最大の原因と私は考えています。
カロリー制限模倣物質および寿命を延ばす食物は、今回言及したもの以外にもたくさんあります。一回で全部を書ききれないので、この連載では、次回以降、有望なカロリー制限模倣物質や寿命を延ばす食物をさらに紹介していきたいと思います。
なお、断続的断食などでカロリー制限を実践しているからといって、カロリー制限模倣物質を摂取しなくてもよいということはありません。一日一食のような極端な断続的断食には弊害も多く、かつ個々のカロリー制限模倣物質の効果は限定的なので、一方でマイルドなカロリー制限を実践しつつ、他方でカロリー制限模倣物質を摂取することで「合わせ技一本」のアンチエイジングを目指す方が、安全で効果的です。それゆえ、カロリー制限実践者の方にも、引き続きこの連載を読んでいただきたいと思います。
4. 動画による要点のまとめ
5. 参照情報
- ↑ LANE, MARK A., DONALD K. INGRAM, and GEORGE S. ROTH. “2-Deoxy-D-glucose feeding in rats mimics physiologic effects of calorie restriction.” Journal of Anti-Aging Medicine 1.4 (1998): 327-337.
- ↑ Shintani, Hideya, Tomoya Shintani, Hisashi Ashida, and Masashi Sato. “Calorie Restriction Mimetics: Upstream-Type Compounds for Modulating Glucose Metabolism.” Nutrients 10, no. 12 (December 2018): 1821.
- ↑ Kulkarni, Ameya S., Sandra Aleksic, David M. Berger, Felipe Sierra, George A. Kuchel, and Nir Barzilai. “Geroscience-Guided Repurposing of FDA-Approved Drugs to Target Aging: A Proposed Process and Prioritization.” Aging Cell 21, no. 4 (2022): e13596.
- ↑ Zou, Cai-Yan, Xue-Kui Liu, Yi-Quan Sang, Ben Wang, and Jun Liang. “Effects of SGLT2 Inhibitors on Cardiovascular Outcomes and Mortality in Type 2 Diabetes.” Medicine 98, no. 49 (December 10, 2019): e18245.
- ↑ Han, Yechen, Hongzhi Xie, Yongtai Liu, Peng Gao, Xufei Yang, and Zhujun Shen. “Effect of Metformin on All-Cause and Cardiovascular Mortality in Patients with Coronary Artery Diseases: A Systematic Review and an Updated Meta-Analysis.” Cardiovascular Diabetology 18, no. 1 (July 30, 2019): 96.
- ↑ Saraei, Pouya, Ilia Asadi, Muhammad Azam Kakar, and Nasroallah Moradi-Kor. “The Beneficial Effects of Metformin on Cancer Prevention and Therapy: A Comprehensive Review of Recent Advances.” Cancer Management and Research 11 (April 17, 2019): 3295–3313.
- ↑ Agostini, Francesco, Anna Masato, Luigi Bubacco, and Marco Bisaglia. “Metformin Repurposing for Parkinson Disease Therapy: Opportunities and Challenges.” International Journal of Molecular Sciences 23, no. 1 (January 2022): 398.
- ↑ Sanati, Mehdi, Samaneh Aminyavari, Amir R. Afshari, and Amirhossein Sahebkar. “Mechanistic Insight into the Role of Metformin in Alzheimer’s Disease.” Life Sciences 291 (February 15, 2022): 120299.
- ↑ Kim, Ji-Won, Jung-Yoon Choe, and Sung-Hwan Park. “Metformin and Its Therapeutic Applications in Autoimmune Inflammatory Rheumatic Disease.” The Korean Journal of Internal Medicine 37, no. 1 (December 10, 2021): 13–26.
- ↑ Mohammed, Ibrahim, Morley D. Hollenberg, Hong Ding, and Chris R. Triggle. “A Critical Review of the Evidence That Metformin Is a Putative Anti-Aging Drug That Enhances Healthspan and Extends Lifespan.” Frontiers in Endocrinology 12 (2021): 718942.
- ↑ Barzilai, N.R. “TARGETING AGING WITH METFORMIN (TAME).” Innovation in Aging 1, no. suppl_1 (July 1, 2017): 743.
- ↑ Renaud, S., and M. de Lorgeril. “Wine, Alcohol, Platelets, and the French Paradox for Coronary Heart Disease.” The Lancet, Originally published as Volume 1, Issue 8808, 339, no. 8808 (June 20, 1992): 1523–26.
- ↑ Fragopoulou, Elizabeth, and Smaragdi Antonopoulou. “The French paradox three decades later: Role of inflammation and thrombosis.” Clinica Chimica Acta 510 (2020): 160-169.
- ↑ Tabrizi, Reza, Omid Reza Tamtaji, Kamran B. Lankarani, Maryam Akbari, Ehsan Dadgostar, Mohammad Hossein Dabbaghmanesh, Fariba Kolahdooz, Amir Shamshirian, Mansooreh Momen-Heravi, and Zatollah Asemi. “The Effects of Resveratrol Intake on Weight Loss: A Systematic Review and Meta-Analysis of Randomized Controlled Trials.” Critical Reviews in Food Science and Nutrition 60, no. 3 (February 4, 2020): 375–90.
- ↑ Asgary, Sedigheh, Raheleh Karimi, Saeideh Momtaz, Rozita Naseri, and Mohammad Hosein Farzaei. “Effect of Resveratrol on Metabolic Syndrome Components: A Systematic Review and Meta-Analysis.” Reviews in Endocrine and Metabolic Disorders 20, no. 2 (June 1, 2019): 173–86.
- ↑ Walle, Thomas. “Bioavailability of Resveratrol.” Annals of the New York Academy of Sciences 1215, no. 1 (2011): 9–15.
- ↑ Lin, Wei-Sheng, Jane Valorie Leland, Chi-Tang Ho, and Min-Hsiung Pan. “Occurrence, Bioavailability, Anti-Inflammatory, and Anticancer Effects of Pterostilbene.” Journal of Agricultural and Food Chemistry 68, no. 46 (November 18, 2020): 12788–99.
- ↑ Obrador, Elena, Rosario Salvador-Palmer, Ali Jihad-Jebbar, Rafael López-Blanch, Thanh H. Dellinger, Ryan W. Dellinger, and José M. Estrela. “Pterostilbene in Cancer Therapy.” Antioxidants 10, no. 3 (March 2021): 492.
- ↑ Chen, Rong-Jane, Hsiao-Che Kuo, Li-Hsin Cheng, Yu-Hsuan Lee, Wen-Tsan Chang, Bour-Jr Wang, Ying-Jan Wang, and Hung-Chi Cheng. “Apoptotic and Nonapoptotic Activities of Pterostilbene against Cancer.” International Journal of Molecular Sciences 19, no. 1 (January 2018): 287.
- ↑ Li, De-Dong, Lan-Xue Zhao, Eleftherios Mylonakis, Gan-Hai Hu, Yong Zou, Tong-Kun Huang, Lan Yan, Yan Wang, and Yuan-Ying Jiang. “In Vitro and In Vivo Activities of Pterostilbene against Candida Albicans Biofilms.” Antimicrobial Agents and Chemotherapy 58, no. 4 (April 2014): 2344–55.
- ↑ Ellen, Bram M. ter, Nilima Dinesh Kumar, Ellen M. Bouma, Berit Troost, Denise P. I. van de Pol, Heidi H. van der Ende-Metselaar, Leonie Apperloo, et al. “Resveratrol and Pterostilbene Inhibit SARS-CoV-2 Replication in Air–Liquid Interface Cultured Human Primary Bronchial Epithelial Cells.” Viruses 13, no. 7 (July 2021): 1335.
- ↑ Lange, Klaus W., and Shiming Li. “Resveratrol, Pterostilbene, and Dementia.” BioFactors 44, no. 1 (2018): 83–90.
- ↑ Riche, Daniel M., Corey L. McEwen, Krista D. Riche, Justin J. Sherman, Marion R. Wofford, David Deschamp, and Michael Griswold. “Analysis of Safety from a Human Clinical Trial with Pterostilbene.” Journal of Toxicology 2013 (February 4, 2013): e463595.
- ↑ Arias, Noemí, M. Teresa Macarulla, Leixuri Aguirre, Iñaki Milton, and María P. Portillo. “The Combination of Resveratrol and Quercetin Enhances the Individual Effects of These Molecules on Triacylglycerol Metabolism in White Adipose Tissue.” European Journal of Nutrition 55, no. 1 (February 1, 2016): 341–48.
- ↑ Ackland, Margaret Leigh. “Synergistic Antiproliferative Action of the Flavonols Quercetin and Kaempferol in Cultured Human Cancer Cell Lines.” In Vivo, 2005, Jan-Feb;19(1):69-76. PMID: 15796157.
- ↑ Saw, Constance Lay Lay, Yue Guo, Anne Yuqing Yang, Ximena Paredes-Gonzalez, Christina Ramirez, Douglas Pung, and Ah-Ng Tony Kong. “The Berry Constituents Quercetin, Kaempferol, and Pterostilbene Synergistically Attenuate Reactive Oxygen Species: Involvement of the Nrf2-ARE Signaling Pathway.” Food and Chemical Toxicology 72 (October 1, 2014): 303–11.
- ↑ Skroza, Danijela, Vida Šimat, Sonja Smole Možina, Višnja Katalinić, Nataša Boban, and Ivana Generalić Mekinić. “Interactions of Resveratrol with Other Phenolics and Activity against Food-Borne Pathogens.” Food Science & Nutrition 7, no. 7 (2019): 2312–18.
- ↑ Griswold, Max G., Nancy Fullman, Caitlin Hawley, Nicholas Arian, Stephanie R. M. Zimsen, Hayley D. Tymeson, Vidhya Venkateswaran, et al. “Alcohol Use and Burden for 195 Countries and Territories, 1990–2016: A Systematic Analysis for the Global Burden of Disease Study 2016.” The Lancet 392, no. 10152 (September 22, 2018): 1015–35.
- ↑ Lupoli, Roberta, Paola Ciciola, Giuseppina Costabile, Rosalba Giacco, Matteo Nicola Dario Di Minno, and Brunella Capaldo. “Impact of Grape Products on Lipid Profile: A Meta-Analysis of Randomized Controlled Studies.” Journal of Clinical Medicine 9, no. 2 (February 2020): 313.
- ↑ Asbaghi, Omid, Fatemeh Naeini, Vihan Moodi, Moein Najafi, Mina Shirinbakhshmasoleh, Mahnaz Rezaei Kelishadi, Amir Hadi, Ehsan Ghaedi, and Abdulmnannan Fadel. “Effect of Grape Products on Blood Pressure: A Systematic Review and Meta-Analysis of Randomized Controlled Trials.” International Journal of Food Properties 24, no. 1 (January 1, 2021): 627–45.
- ↑ McCormack, Denise, and David McFadden. “A Review of Pterostilbene Antioxidant Activity and Disease Modification.” Oxidative Medicine and Cellular Longevity 2013 (April 4, 2013): e575482.
- ↑ Sezer, Ebru Demirel, Latife Merve Oktay, Elif Karadadaş, Hikmet Memmedov, Nur Selvi Gunel, and Eser Sözmen. “Assessing Anticancer Potential of Blueberry Flavonoids, Quercetin, Kaempferol, and Gentisic Acid, Through Oxidative Stress and Apoptosis Parameters on HCT-116 Cells.” Journal of Medicinal Food 22, no. 11 (November 2019): 1118–26.
- ↑ Carvalho, Marina Fernandes, Ana Beatriz Araújo Lucca, Vítor Rodrigues Ribeiro e Silva, Leandro Roberto de Macedo, and Maísa Silva. “Blueberry Intervention Improves Metabolic Syndrome Risk Factors: Systematic Review and Meta-Analysis.” Nutrition Research 91 (July 1, 2021): 67–80.
- ↑ Davidson, Kristoffer T., Ziwen Zhu, Dean Balabanov, Lei Zhao, Mark R. Wakefield, Qian Bai, and Yujiang Fang. “Beyond Conventional Medicine – a Look at Blueberry, a Cancer-Fighting Superfruit.” Pathology & Oncology Research 24, no. 4 (October 1, 2018): 733–38.
- ↑ 株式会社つくば分析センター「カナダ産冷凍ブルーベリーからビフェントリン検出」『残留農薬ニュース』.
- ↑ Huang, Haohai, Dan Liao, Yong Dong, and Rong Pu. “Effect of Quercetin Supplementation on Plasma Lipid Profiles, Blood Pressure, and Glucose Levels: A Systematic Review and Meta-Analysis.” Nutrition Reviews 78, no. 8 (August 1, 2020): 615–26.
- ↑ Dabeek, Wijdan M., and Melissa Ventura Marra. “Dietary Quercetin and Kaempferol: Bioavailability and Potential Cardiovascular-Related Bioactivity in Humans.” Nutrients 11, no. 10 (October 2019): 2288.
- ↑ Huang, Wang, Gang Tang, Linyu Zhang, Jie Tao, and Zhengqiang Wei. “Effect of Onion on Blood Lipid Profile: A Meta-Analysis of Randomized Controlled Trials.” Food Science & Nutrition 9, no. 7 (2021): 3563–72.


コメント