ヤクルト1000のブームをきっかけに、腸内細菌によるストレス解消やその理論的根拠である脳腸相関が注目されるようになりました。脳と腸という一見何の関係もなさそうな二つの臓器がなぜ相互に影響を与えるのかという謎を解くには、腸と脳が進化の過程でどのように誕生したのかを知る必要があります。この記事では、脳腸相関の誕生を進化論的に説明しつつ、腸内環境改善のためにどうすればよいかを考えます。
1. なぜ脳と腸は相関するのか
脳腸相関の謎を解くには、海綿動物、刺胞動物、原索動物といった脊椎動物以前の原始的な多細胞動物(後生動物)にまで進化の歴史を遡る必要があります。この章では、腸と脳の誕生プロセスをたどりながら、消化器系と循環器系の分離が二重のセキュリティ関門の形成をもたらしたことを説明します。
1.1. 脳腸誕生の進化論的プロセス
腸は、脳から指令を受けなくても、腸管の蠕動(ぜんどう)や消化酵素の分泌や血流の調節を制御できる腸管神経系を持ちます。私たちの体で、独自の神経ネットワークを持つのは腸だけであることから、腸はしばしば「第二の脳」と呼ばれます。しかし、進化の順番からするなら、むしろ腸管神経系の方が第一の神経系で、脳を頂点とする中枢神経系は、その後で発達したという意味で第二の神経系です。
実際、脳を持たないけれども、腸に相当する部位を持つ生物がいます。例えば、海綿動物がそうです。海綿動物は、神経系すら持たない極めて単純な動物で、約8億9000万年前の岩石にその化石証拠が見いだされた[1]ことから、地球上に最初に出現した後生動物と考えられています。海綿動物は、後生動物に一番近い単細胞生物(原生動物)、立襟鞭毛虫(たてえりべんもうちゅう)の群体から進化した可能性があります。以下に図示した海綿動物の構造でも、その痕跡が窺えます。

海綿動物の流水系は、アスコン型、サイコン型、ロイコン型に大別できますが、どの型でも、襟細胞(赤色の部位)の鞭毛の働きにより、水が体表面の小孔から入って、中腔を経て、大孔から出ていきます。その過程で、襟細胞が水中の微小生物を捕らえ、消化・吸収します。私たちの体では、消化器系と循環器系は別のシステムとなっていますが、海綿動物では両者が未分化であることがこの図からわかります。
海綿動物には神経系がありません。神経系を有して、海綿動物より進化した放射相称動物が、クラゲ、ヒドラ、サンゴ、イソギンチャクなどの刺胞動物です。神経系といっても、中枢神経系とは異なり、体表に一様に分布する散在神経系しかありません。それでも、刺激に対して体を縮めるなどの単純な反応を示せます。その反応は、腸管神経系による腸管の蠕動と似ています。
ここでは、ヒドラを例にとりましょう。以下の写真に見られるとおり、ヒドラは、刺胞で傷ついた獲物から放出されるグルタチオンに反応して、触手を縮め、獲物を口内に取り込み、腔腸内で消化します。
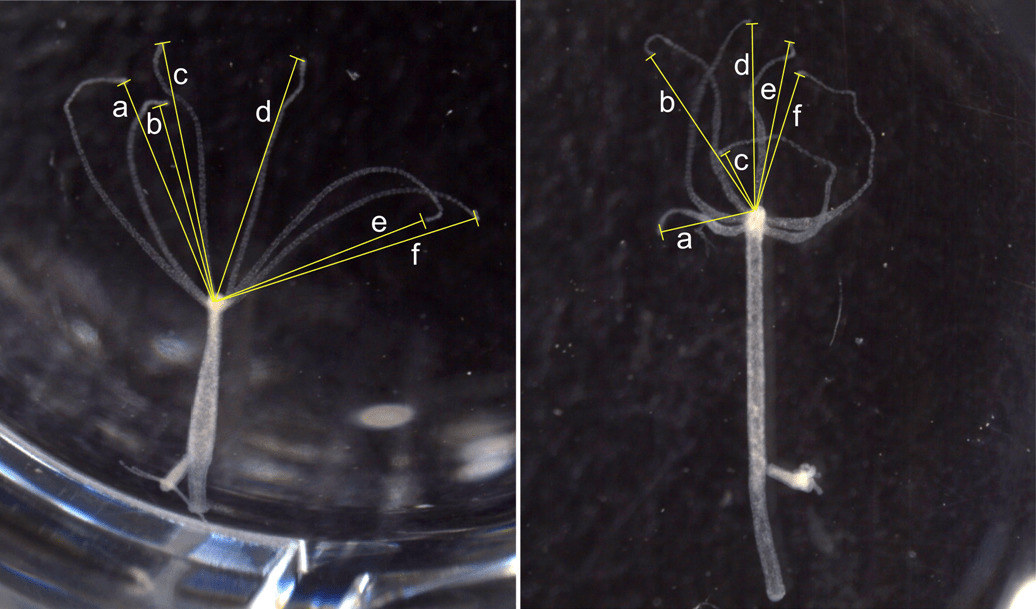
私たちの腸内に様々な細菌が共生していることはよく知られていますが、ヒドラにも細菌が共生していて、ヒドラの自発的な体の収縮を調節しています。ちょうど腸内環境が悪化すると、腸の蠕動が停滞して、慢性便秘などの障害が起きるように、ヒドラでも、共生細菌が減ると、自発的収縮に支障を来すようになります[2]。
刺胞動物でも、海綿動物と同様に、消化器系と循環器系が未分化です。循環器系が消化器系から分化するのは、無脊椎動物と脊椎動物の中間に位置する原索動物においてです。ナメクジウオやホヤなどの原索動物は、脊索と中空の神経管を脊索の背方に持ちますが、こうした管状神経系は中枢神経系とは異なります。以下の図は、ナメクジウオの解剖学的構造の図です。
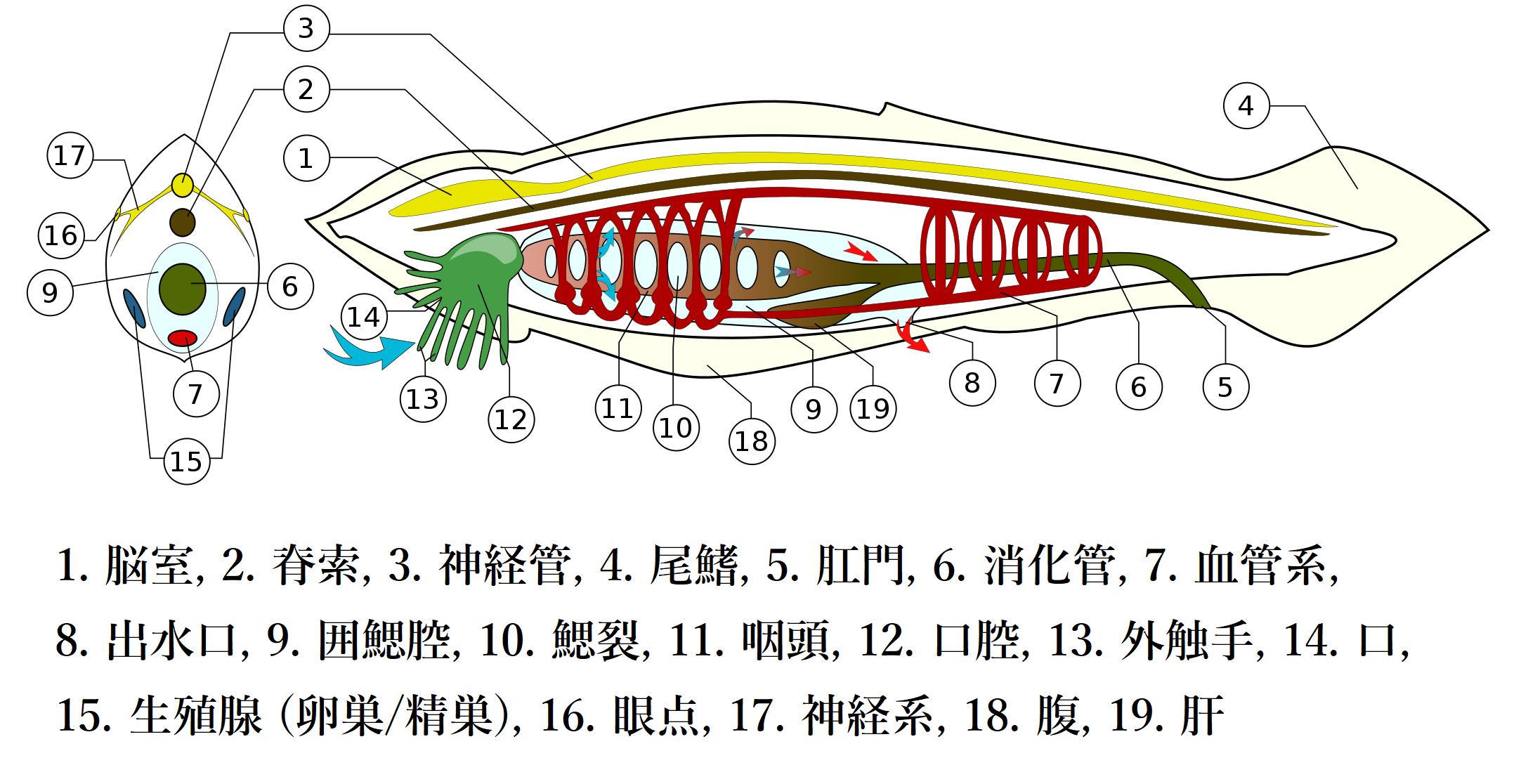
ナメクジウオは、この図において緑色で印した外触手で捕まえた獲物を、⑥の消化管で消化し、栄養を吸収した後、⑤の肛門から排泄します。赤色で印した血管系が、それらの消化管とは別であることを確認してください。
①の脳室は、脳のようなふくらみという意味で、脳ではありません。脳が誕生するのは、脊椎動物が登場してからです。最近の研究[3]によると、私たちと同じ脳領域が、5億年以上前からいたとされる無顎脊椎動物(現在のヤツメウナギやヌタウナギなどの円口類)に認められています。以下は、ヤツメウナギの写真です。

中枢神経の誕生後、免疫系も進化しました。免疫とは、有害な微生物やウイルスの侵入を阻止するための防御システムです。免疫には先天的な自然免疫と後天的な獲得免疫とがあります。自然免疫は有顎脊椎動物以前からありました。海綿のような神経系を持たない動物ですら、自分の組織移植は受け入れても、他の組織移植は拒否するといった反応を示します。とはいえ、有顎脊椎動物以前の動物には胸腺もリンパ組織もなく、もっぱら原始的な細胞性免疫に依存しており、抗体産生を介した液性免疫の出現は、有顎脊椎動物の誕生を待たなければなりません。
有顎脊椎動物は、中枢神経系を発達させましたが、だからといって、散在神経系が完全になくなったわけではありません。それは腸管神経系として今でも私たちの体に残っています。腸管神経系は免疫系と密接な関係にあって、ちょうど中枢神経系のミクログリアが、ケモカインなどを介して神経免疫調節に関与するように、腸管神経系の消化管グリア細胞(enteric glial cell)も、ケモカインなどを介して腸管の恒常性維持、免疫、組織修復に重要な役割を果たしています[4]。神経系と免疫系は、ともに情報システムなのですから、協働は当然です。中でも、腸管神経系は、腸という外部環境とのインターフェースを管轄しているだけあって、腸の免疫機能にも大きく関わっています[5]。
以上、神経系と循環系と免疫系が誕生し、発達していった経緯を説明しました。以下の表は、その進化のプロセスを表にしてまとめたものです。
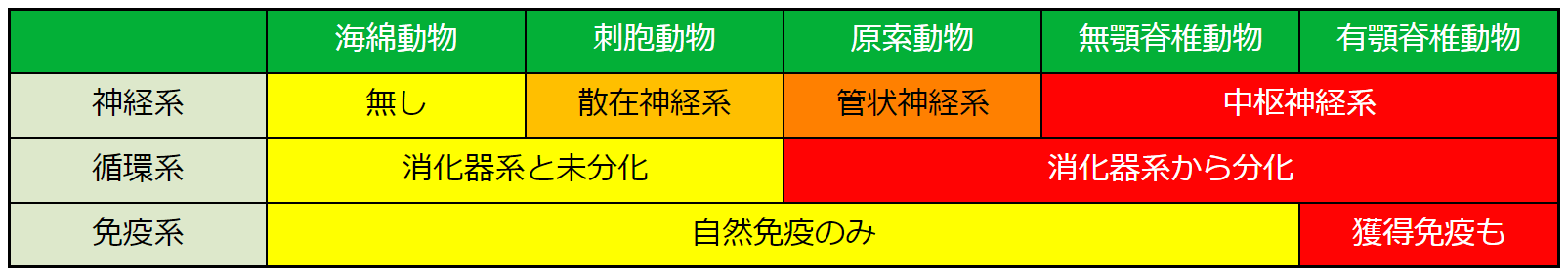
最初に腸と腸管神経系に相当するシステムができ、次に循環系が消化器系から独立して、その後で脳と獲得免疫ができたということです。このプロセスを踏まえた上で、脳腸相関の謎を解きましょう。
1.2. 二重のセキュリティ関門
腸には人体の免疫細胞の70~80%[6]が集まっています。免疫機能が集中していることは、独自の神経系を持つことと並んで、腸という臓器の大きな特徴です。この二つの特徴は、進化の歴史を振り返れば、容易に理解できます。
最初期の後生動物である海綿動物や刺胞動物は、消化器系と循環器系とを分離していないので、腸に相当する器官を外部環境に直接晒しています。建物に喩えるなら、以下の図のように、門を介して直接外界とつながっている構えです。
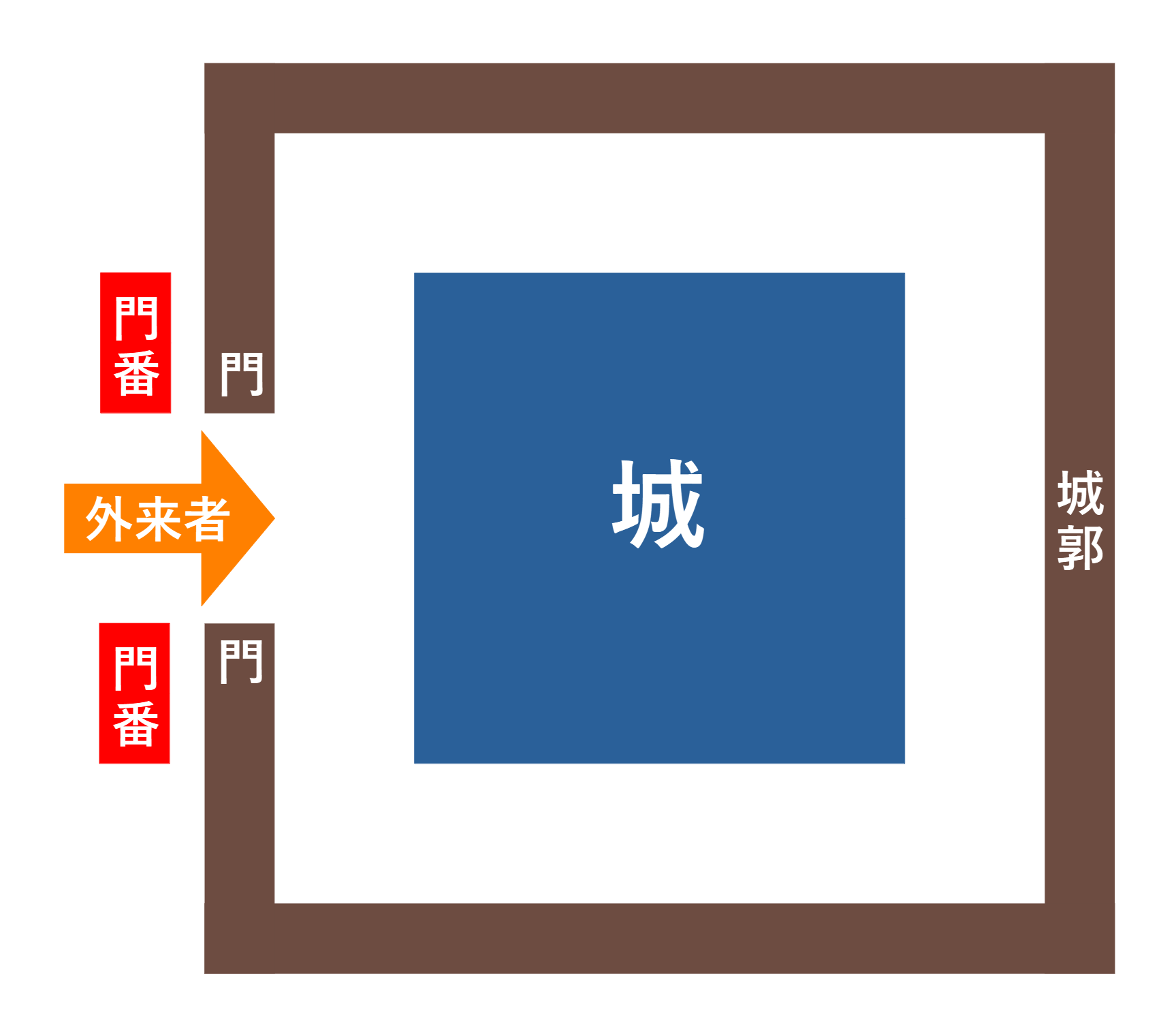
今、この建物が、堅固な城郭で囲まれた城としましょう。すると、城に入ろうとする外来者は、門を通るしかありません。それゆえ、外来者を検問する見張りは門の前に置かなければなりません。

門番は、外来者を通して良いかどうかを判断します。必要な外来者なら、門を開けて中に通します。敵と判断すれば、門を閉じ、外来者を捕らえて殺すでしょう。この役割を果たすのが、腸管神経系と免疫系です。これらのシステムは、腸内に異物を吸収してよいかどうかを判別します。異物が有益な栄養なら、吸収し、異物が有害な細菌やウイルスなら、それらを攻撃して、無効化します。ちょうど門番が門の前に張り付いているように、神経系と免疫系は、腸の入り口に張り付いて、こうした仕事をしているのです。
生物がウイルスから身を守らなければいけないように、コンピューターもコンピューター・ウイルスから身を守らなければいけません。一家に一台しかコンピューターがない時代には、そのコンピューターにセキュリティ・ソフトを入れるだけでしたが、複数の端末を使うようになると、各端末にセキュリティ・ソフトを入れるだけでなく、外部からの最初の関門であるホームルーターにセキュリティ・ソフトを入れるようになりました。生物の進化も似たようなプロセスをたどります。
原索動物以降、消化器系と循環器系とが分化しました。その結果、腸が直接外部環境に晒されなくなり、代わりに口が外部環境に開かれた入り口となりました。これは、喩えるなら、内郭と外郭という二重の城郭で守られた城のような構えです。

外郭で門番の役割を果たすのが、感覚器官とそこから入力される情報に基づいて判断を下す中枢神経系、すなわち脳です。多くの人は、頭に口と鼻が二次的に付属していると思っていますが、実際には、口と鼻があるからこそ、そこが目や耳や脳がある頭になったのです。それは、門があるからこそ、そこに門番がいるのであって、その逆ではないのと同じことです。
無顎脊椎動物のヤツメウナギの頭には、眼点という光のセンサーが付いていますが、脳に相当する中枢神経系はありません。私たちの体では、異物が入る門である口と鼻に味覚と嗅覚という感覚器官が門番として見張っているだけでなく、目や耳といった感覚器官も門の近くにあり、かつ、脳が、これらの感覚器官から情報を収集し、それに基づいて、異物を中に入れるべきか、排除すべきかを判断し、行動を起こします。それは、まさに外郭における門番の仕事と言ってよいでしょう。
日本の城郭は、戦国時代の初期には単純な形のものが多かったのですが、時代とともに城が大型化し、防御も重層化しました。この点でも、生物の進化とよく似ています。戦国時代の終わりに建造された大阪城や江戸城などの大規模な城は、上掲のイラストでは省略しましたが、内郭と外郭に内堀と外堀を巡らせて、二重の防御を強化する一方で、内郭と外郭の間に家臣や商人を住まわせ、城下町を形成しました。
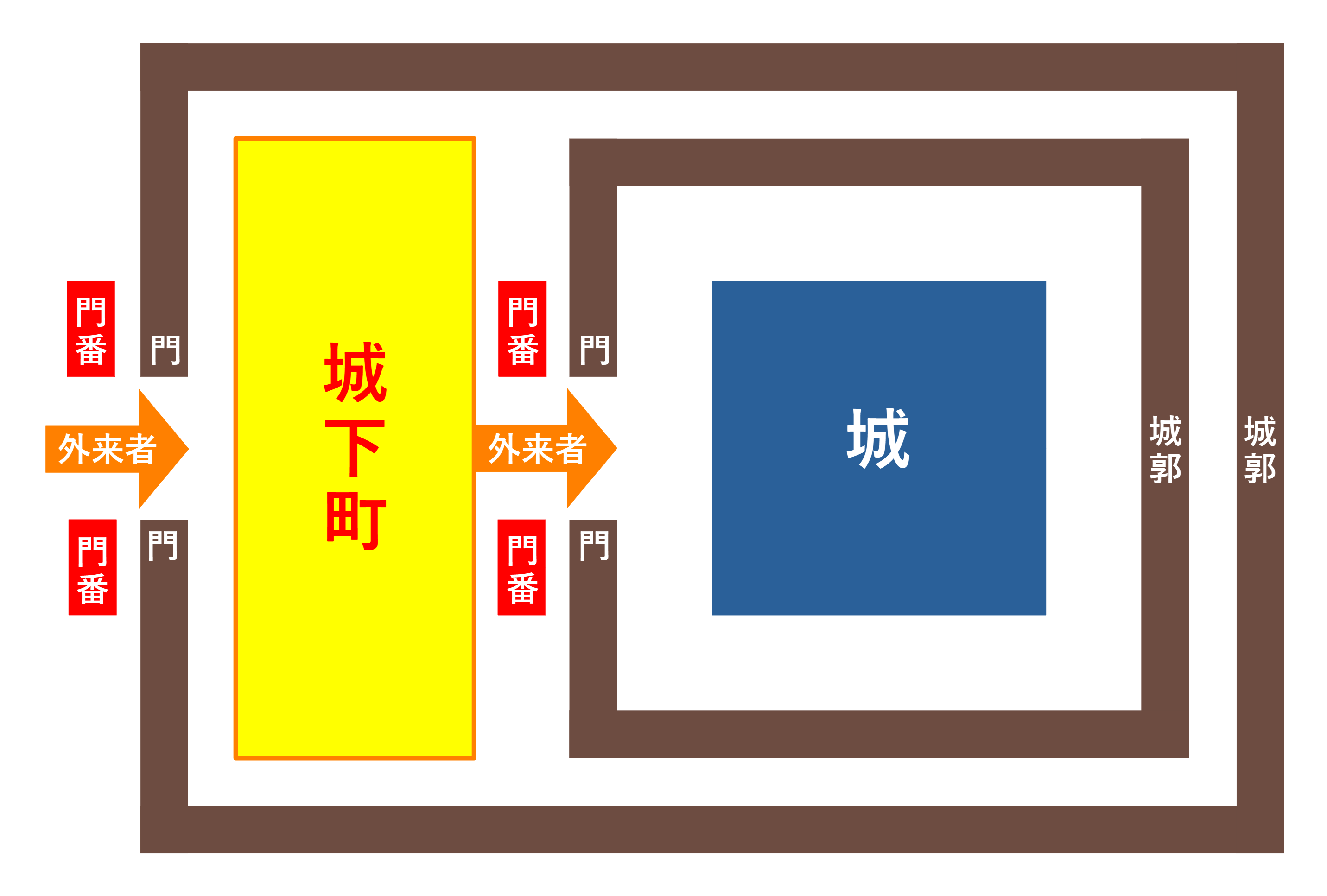
城下町の商人たちは、自分たちの利益のために商売をしているのですが、彼らの商業活動は、結果として城に富をもたらします。城下町の商人に相当するのが、腸内細菌です。腸内細菌は、自分たちの利益のために代謝しているのですが、彼らの代謝活動は、結果として宿主に恩恵をもたらします。
城下町の経済の悪化が城にとって好ましくないように、腸内環境の悪化は宿主の健康にとって有害です。腸内細菌が脳と腸に大きな影響を与えることから、脳腸相関(Gut-Brain Axis 腸脳軸)は脳腸微生物相関(Microbiota-Gut-Brain Axis 微生物腸脳軸)と呼ばれることもあります。
腸内細菌だけでなく、口内細菌も私たちの健康に重大な影響を与えます。口内細菌は、城の喩えで言うと、外郭の外に住む一般民衆で、彼らの経済活動も城にとって重要です。しかし、口内細菌の話はまた別の機会に譲って、今回は、腸内細菌の話に限定しましょう。
1.3. 腸内細菌と脳の相互作用
脳腸相関はあまり精確な表現ではなく、機能的にパラレルに対応させると、腸に相当するのは頭(口と鼻)で、脳に相当するのは腸管神経系で、腸内細菌に相当するのは口内細菌で、腸の免疫系の働きに相当するのは、脳の指令を受けた体の働きです。外郭の門と門番である口と脳は、内郭の門と門番である腸と腸管神経系と役割が同じ情報システムであるため、両者は相互に情報を交換する必要があります。その主要な情報伝達経路は、迷走神経(Vagus nerve)です。迷走神経の内、腸から脳に情報を送る求心性神経が80~90%、脳から腸に情報を送る遠心性神経は10~20%を占めます[7]。内郭の門番から外郭の門番への情報伝達の方が、逆方向よりも重要度が高いからなのでしょう。
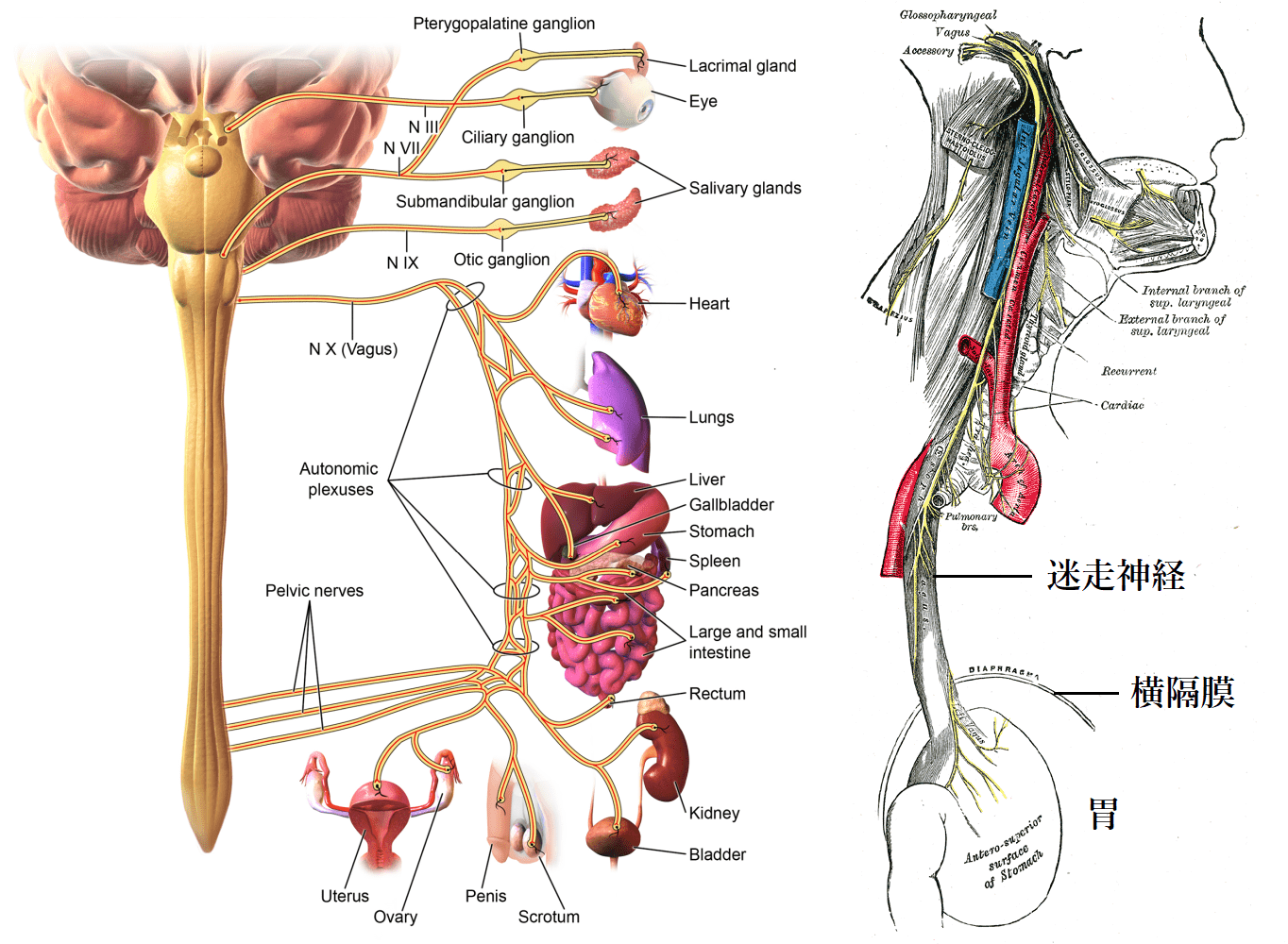
腸内細菌は、腸管神経系、免疫系、迷走神経などを通じて脳と双方向のコミュニケーションを行っています。その中でも迷走神経が主要な情報伝達経路であることは、迷走神経を切断した動物実験の結果から明らかになっています[8]。例えば、2011年のマウスを用いた実験[9]によると、乳酸菌(Lactobacillus rhamnosus)の経口摂取が不安や鬱病関連の行動を減少させる効果が、求心性迷走神経の切断でなくなりました。他方で、2006年のマウスを用いた実験[10]によると、迷走神経切断が潰瘍性大腸炎を悪化させたことから、遠心性迷走神経には腸の炎症を抑制する働きがあると考えられています。つまり、腸内環境の悪化が脳を不安にする一方で、そのストレスで腸に炎症が起きるという悪循環が脳腸相関のコミュニケーションで起きうるということです。
2020年発表のオックスフォード大学の研究[11]によると、腸内細菌は人の性格とまで相関するとのことです。具体的な解析結果として、社交的な性格の人の腸には、オシロスピラ属細菌(P<0.001)、ラクトコッカス属細菌(P=0.002)、アッカーマンシア属細菌(P=0.038)が有意に多く、デスルフォビブリオ属細菌(P=0.019)とサテレラ属細菌(P=0.028)は有意に少ないことがわかりました。自閉症患者では、前者三つの細菌が少なく、後者二つの細菌が多いと既に報告されており、社交的か自閉的かという性格が腸内環境と相関することは、首肯せざるをえません。
こうした最近の発見から、腸は「第二の脳」と呼ばれようになったのですが、実は、日本人は昔からそうした観念を持っていました。「腹が立つ」、「腹が癒える」、「腹の内を探る」、「腹に一物ある」、「腹を決める」、「腹が据わる」などの慣用表現からもわかるとおり、日本人は腹の中に魂が宿ると思っていました。そうした考えは、日本人だけでなく、世界の多くの古代民族が持っていたのですが、日本人は、近代まで真心は腹の奥、特に腸の中にあると信じていたようです。武士は、切腹の際、腸(はらわた)を取り出すことがありましたが、これは腸に宿る魂を解放するという意味合いがあったと考えられます。

もっと興味深い日本語の表現は、「腹の虫が治まらない」とか「腹の虫の居所が悪い」とかいった言い回しに登場する「腹の虫」です。「腹の虫」を腸内細菌と解釈するなら、日本人の直感は、なかなか好い線を行っていると評価できます。オックスフォード大学の研究でも、神経症的な人の腸には、コリネバクテリウム属細菌(P<0.001)とストレプトコッカス属細菌(P=0.029)が有意に少ないという結果が出ています。そういう意味で、腹が立つのは、「腹の虫の居所が悪い」からと言えそうです。
2. プロバイオティクスの健康効果
前の章で、私たちの心の健康が良好な腸内環境に依存していることを確認しました。腸内環境を改善する上で鍵となるのが、プロバイオティクスとプレバイオティクスです。プロバイオティクスとは、腸内フローラを改善する共生細菌で、プレバイオティクスは、プロバイオティクスの栄養源となる食品です。城下町の喩えで言うと、プロバイオティクスが商人であるのに対して、プレバイオティクスは商品です。城の経済を維持するためには、つまり、体の健康を維持するには、両者の絶えざる供給が必要です。プレバイオティクスは次の章で取り上げることにして、この章では、プロバイオティクス摂取による腸内環境の改善策を考えます。
2.1. 乳酸菌飲料の健康効果
プロバイオティクスとプレバイオティクスは、どちらも腸の健康にとっては必要であることから、まとめてシンバイオティクスと呼ぶこともありますが、心の健康という点では、どちらを摂取しても効果は同じということはありません。2019年に発表されたメタアナリシス[13]によると、プレバイオティクス摂取が鬱病(p = 0.51)または不安(p = 0.11)を解消する効果は、プラセボと比べて有意差がなかったのに対して、プロバイオティクス摂取は、鬱病(p < 0.01)および不安(p = 0.03)に対して、小さいながらも有意な抑制効果をもたらしたとのことです。プレバイオティクスに鬱の症状を和らげる効果があるとするメタアナリシス[14]もありますが、抗鬱作用や抗不安作用という点では、プレバイオティクスよりもプロバイオティクスの方が重要ということです。
プロバイオティクスの中でも特に有名なのが乳酸菌(ビフィズス菌、アシドフィルス菌、フェーカリス菌など)です。乳酸菌は腸内を弱酸性にすることで、塩基性環境下で進む腐敗や有害な細菌の繁殖を抑制します。近年、乳酸菌の重要性が知られるにつれ、乳酸菌による腸活が流行となっています。特に、2021年にヤクルトが販売を開始したヤクルト1000(宅配用のYakult1000と店頭販売用のY1000)は、2022年に著名芸能人が、飲んでから寝付きが良くなったと言って紹介したことがきっかけでブームに火が付き、店頭での入手が困難になるほどの人気となりました。

ヤクルト1000は、乳酸菌シロタ株(Lactobacillus casei strain shirota)を一本当たり1000~1100億個含む飲料です。2021年発表の論文で、ヤクルトの研究者たちは、次のように報告しています。
我々は弊社独自のプロバイオティクスLactobacillus casei Shirota株 (LcS) の腸内環境改善作用に着目し, 脳腸軸を介する機能に関する研究を進めてきた。これと並行して, 脳腸軸に対するLcSの効果を最大限に引き出す発酵乳飲料を開発するため, 使用原料や培養技術等の改良を行い, これまでの飲料に含まれるLcSの菌数・菌密度をさらに向上させることに成功した。そこで, 学術試験の受験による心理的ストレスを感じている健常な医学部生を対象とした二重盲検並行群間比較試験にて, 高菌数および高密度化したLcS発酵乳飲料の効果を検証した。その結果, LcS飲料はプラセボ飲料に比べ, 学術試験が近づくにつれ増加するストレスの体感を軽減し, 唾液コルチゾール濃度上昇を有意に抑制した。また, LcS飲料の摂取は, 睡眠の質を向上させることにより学術試験ストレスに伴う睡眠状態の悪化を軽減することを見出した。以上の成果を活用し,「機能性表示食品」として届出を行い, 商品の保健機能表示が可能となった。[15]
要するに、大量に腸に送り込んだプロバイオティクスの抗不安作用により、睡眠の質が改善したということです。睡眠の質の改善は、健康にとって重要ですが、だからといって、ヤクルト1000を長期にわたって継続して飲みましょうというヤクルト・レディたちの推奨を鵜呑みにしてはいけません。私たちは、ともすれば健康商品の有効成分に目を奪われがちですが、同時に健康にとってネガティブな要素がないかどうかをもチェックする必要があります。Y1000の原材料名をみると、「砂糖(国内製造)、脱脂粉乳、ぶどう糖果糖液糖、高果糖液糖/安定剤(大豆多糖類)、香料[16]」とあります。「健康に良い飲み物は何か」で警告したように、砂糖、ぶどう糖果糖液糖、高果糖液糖といったフルクトースを大量に含む飲み物は要注意です。短期的な試飲ならともかくも、長期的継続的摂取は考え物です。
ある食品のポジティブな健康効果がネガティブな健康効果を上回っているかどうかを検証する際に重要なのは、全原因死亡率です。全原因死亡率の死因の中には事故死や自殺まで含まれていますが、これらの死因も、プロバイオティクスの健康効果を確認する上で無視できません。睡眠障害で注意力が低下して事故が起きるとか、鬱の深刻化が自殺の引き金になるとかといったことが考えられるからです。ヤクルト1000は最近発売された商品なので、これの長期的摂取が全原因死亡率にどのような影響を与えるかはわかりません。しかし、そもそもヤクルト1000のような乳製品乳酸菌飲料は、発酵乳製品(ヨーグルト)が原料になっているのですから、ヨーグルトのデータを見れば、乳製品乳酸菌飲料の健康効果もわかるはずです。
2.2. ヨーグルトの健康効果
市販の乳酸菌飲料にはフルクトースが含まれますが、ヨーグルトなら、糖質をほとんど含まないプレーン・ヨーグルトを選べます。原材料名に、生乳、乳製品としか記載されていない純粋なヨーグルトなら、添加物の問題はありません。プレーンでは物足りないという人は、フルーツと一緒に食べると良いでしょう。「健康に良い甘味料は何か」で述べたとおり、フルクトースを含む飲み物は有害ですが、固形の果物なら問題ありません。

ヨーグルトは、おそらく世界で最もポピュラーなプロバイオティクスでしょう。一般社団法人日本健康食育協会が、首都圏在住の20歳以上60歳未満の女性3000人を対象に、実践した経口腸活方法を尋ねたところ、最も多かったのはヨーグルトで、その後、納豆、漬物・キムチ、味噌・味噌汁、チーズ、乳酸菌飲料が続いた[17]とのことですから、日本でも最もポピュラーなプロバイオティクスと言えそうです。
では、ヨーグルトの摂取は、死亡率を低下させるのでしょうか。1990年から25年間、3万4161人の宮城県の中高年(40~64歳)を追跡した宮城コホート研究[18]によると、非摂取者と比較したヨーグルト摂取者の多変量調整済みハザード比は、男女とも、全原因死亡率、心血管疾患死亡率、がん死亡率のすべてで有意に1を下回りませんでした。要するに、ヨーグルトを食べても、死亡率は有意に上がりも下がりもしなかったということです。
しかし、8本の前向きコホート研究をまとめた2020年発表のメタアナリシス[19]によると、毎日200g以上ヨーグルトを食べる人の非摂取者と比較した多変量調整済み相対リスクは、
- 全原因死亡率で、0.88(95%信用区間:0.80~0.96)
- 心血管疾患死亡率で、0.87(95%信用区間:0.77~0.99)
- がん死亡率で、0.90(95%信用区間:0.69~1.17)
となりました。全原因死亡率と心血管疾患死亡率が有意に1を下回っています。このメタアナリストの著者たちによると、これまでヨーグルト摂取に死亡率を低下させる効果がないとみなされてきたのは、比較している摂取量が少なすぎたからとのことです。宮城コホート研究でも、最もヨーグルトを食べていると分類したカテゴリーですら、週三回以上の摂取でしかありません。日本で販売されている食べきりサイズのヨーグルトの容量は100g程度ですから、毎日200g以上ヨーグルトを食べる人はかなり少数に違いありません。大量摂取者を無視した結果、ヨーグルトの健康効果を確認できなかったのでしょう。

もとより、私は、このメタアナリシスを根拠に毎日200g以上ヨーグルトを食べることを推奨するつもりはありません。このメタアナリシスの結論は、統計的に有意な違いを出すには、毎日200g以上のヨーグルトに相当するプロバイオティクスを摂取しなければならないと解釈すべきです。リスク分散という観点からするなら、プロバイオティクスをヨーグルトという一種類の食品から取るよりも、納豆、漬物、味噌汁など多様な食品から摂った方が賢明です。これらの発酵食品の健康効果に関しては、「大豆は健康に良いのか」で詳しく述べたので、リンク先のページを参照してください。
特定保健用食品や機能性表示食品の表示があるヨーグルトに含まれる乳酸菌は生きて腸まで届くと考えられています。しかし、生きたまま腸に届いたとしても、そのまま定着することはなく、最終的には排泄されてしまいます。また、死んだからといって腸内環境の改善に役立たないということもありません。それゆえ、本当に生きたまま届いているかどうかに関して、それほど神経質になる必要はありません。
2.3. チーズの健康効果
多くの人が食べるもう一つの発酵乳の食品にチーズがあります。乳を乳酸菌と凝乳酵素によって熟成させたナチュラル・チーズには、生きた乳酸菌がいますが、ナチュラル・チーズを加熱して固めたプロセス・チーズには生きた乳酸菌はいません。そうした違いはあるにせよ、両者とも発酵乳の食品と言えます。
チーズに関する9本の前向きコホート研究をまとめた2017年発表のメタアナリシス[20]によると、非摂取者と比較したチーズ最摂取者の多変量調整済み全原因死亡率ハザード比は、1.02(95%信用区間:0.97~1.06)でした。用量依存的な線形のトレンドも確認できず、チーズは健康にニュートラルという結論となっています。
2019年発表の乳製品全般の健康効果を調べたメタアナリシス[21]は、被験者をチーズの摂取量で四等分して、四分位ごとの多変量調整済み全原因死亡率ハザード比を算出しています。
- 最下位1/4:1(基準)
- 下位1/4:0.98(95%信用区間:0.84~0.98)
- 上位1/4:0.95(95%信用区間:0.82~0.99)
- 最上位1/4:0.92(95%信用区間:0.87~0.97)
全て有意に1を下回りました。用量依存的な死亡率の低下も有意です(p < 0.001)。ただし、2019年発表のメタアナリシスは、2017年発表のメタアナリシスよりも後に出版されていますが、チーズだけを調査したのではなく、2017年発表のメタアナリシスよりも包括的とは言い難いので、こちらだけを信用するわけにはいきません。
チーズの摂取が死亡率を低下させるかどうかに関するこれまでの研究の結論は一致していません。結果がまちまちになるのは、一口にチーズと言っても様々な種類があるにもかかわらず、ひとまとめにして調査しているからなのかもしれません。市販のプロセス・チーズは多くの添加物を含んでいます。ナチュラル・チーズですら、添加物を含んでいるものがあります。チーズを選ぶ時は、原材料名に生乳以外の記載が少ないものを選んだ方が賢明です。

「健康に良い飲み物は何か」で既に指摘したように、牛乳は好ましい成分を含む一方で、成長促進カスケードを促進するために、全体としては健康にニュートラルな食品となっています。発酵乳製品は、牛乳よりも健康にポジティブですが、ネガティブな成分を原材料の牛乳から引き継いでいるので、死亡率を低下させる顕著な効果はありません。プロバイオティクスを乳製品にのみ依存することなく、植物性のプロバイオティクスで多様化を図らなければならない所以です。
3. プレバイオティクスの健康効果
心の健康への効果という点で、プレバイオティクスはプロバイオティクスに及びませんが、プロバイオティクスの栄養源ですから、腸内環境の改善には欠かせません。この章では、プレバイオティクスの種類と効能を確認した上で、どのような食材からプレバイオティクスを摂取すればよいかを考えます。
3.1. プレバイオティクスの種類
プレバイオティクスには以下のような種類があります。
- 水溶性食物繊維:水に溶ける食物繊維
- 不溶性食物繊維:水に溶けない食物繊維
- オリゴ糖:3糖以上10糖以下の少糖類
- 糖アルコール:糖のアルデヒド基が還元されて生じた多価のアルコール
- レジスタント・スターチ:難消化性でんぷん
- レジスタント・プロテイン:難消化性たんぱく質
プレバイオティクスは、小腸で吸収されにくいため、肥満の原因とならない反面、腸内細菌の栄養源となります。中でもプレバイオティクスとして特に重要なのは、大腸内のビフィズス菌や酪酸菌などによって、酢酸、プロピオン酸、酪酸といった短鎖脂肪酸となる水溶性食物繊維とオリゴ糖とレジスタント・スターチです。短鎖脂肪酸は、大腸で吸収され、大腸と全身の栄養源となるだけでなく、大腸内のpHを下げて、有害な細菌の増殖を防いだり、腸の免疫機能や抗炎症作用を強化したり、腸管の粘液の分泌や水やミネラルの吸収を促したり、代謝を促進して、脂肪の蓄積を防いだりと多くの役割を果たしているからです。
3.2. プレバイオティクスの効能
プレバイオティクスの健康効果を、最近発表されたメタアナリシスで確認しましょう。
2017年発表のメタアナリシス[22]は、C反応性蛋白(CRP)や腫瘍壊死因子-α(TNF-α)といった炎症性疾患のマーカーを指標としてプレバイオティクスとプロバイオティクスの抗炎症作用を調べました。それによると、プレバイオティクスのプラセボと比較した標準化平均差は、
- CRPで、-0.60(95%信用区間:-0.98 ~ -0.23, P = 0.002, I2= 64%)
- TNF-αで、-0.49(95%信用区間:-1.20 ~ 0.22, P = 0.18, I2= 84%)
となり、C反応性蛋白のみ有意でした。シンバイオティクス(プロバイオティクス+プレバイオティクス)のプラセボと比較した標準化平均差は、
- CRPで、-0.40(95%信用区間:-0.73 ~ -0.06, P = 0.02, I2= 78%)
- TNF-αで、-0.90(95%信用区間:-1.50 ~ -0.30, P = 0.003, I2= 78%)
となり、両方で有意となりました。ここから、プレバイオティクス単独投与にも一定の抗炎症作用があり、それはプロバイオティクスの投与で強化されると言えそうです。
2021年発表のメタアナリシス[23]によると、食物繊維の摂取は、糖尿病の症状を改善します。中央値10g/日の食物繊維を中央値8週間摂取したところ、対照群との加重平均差は、
- HbA1cで、-0.66%(95%信用区間:-0.94 ~ -0.38%, p = 0.000, I2=82.4%)
- 空腹時血糖値で、-0.80 mmol/L(95%信用区間:-1.14 ~ -0.46 mmol/L, p = 0.000, I2=81.6%)
- HOMA-IRで、-1.27(95%信用区間:-2.18 ~ -0.36, p = 0.006, I2=81.8%)
といずれも有意な減少となりました。これは二型糖尿病患者を対象にした調査ですが、2018年のメタアナリシス[24]によると、食物繊維の摂取は、一般にメタボリック・シンドロームの予防に役立つとのことなので、プレバイオティクスの摂取は、健常者にも利益をもたらします。
3.3. プレバイオティクスの摂取
では、プレバイオティクスを摂取するには、何を食べればよいのでしょうか。実は、これまで推奨してきた食品の中には、プレバイオティクスが豊富な食品もあるので、それを振り返りましょう。
- 「糖質制限よりも糖質選別」で、低GI/低GLの糖質源としてサツマイモを推奨しました。サツマイモは、水溶性食物繊維が豊富で、蒸すか茹でたサツマイモを冷やすと、レジスタント・スターチが豊富になります。サツマイモは、腸活という点でもお薦めの食品です。
- 「健康に良い甘味料は何か」では、代替甘味料の一つとしてオリゴ糖を挙げました。ラフィノースなど市販のオリゴ糖は甘さが控えめなので、代替甘味料としてはやや魅力に欠けますが、オリゴ糖は大腸で酪酸となるので、腸活用食材としては優秀です。
- 「大豆は健康に良いのか」では、カロリー制限模倣物質のスペルミジンを多く含む食品として、納豆と小麦胚芽を推奨しました。納豆は典型的なプロバイオティクスですが、原材料の大豆には、水溶性食物繊維、不溶性食物繊維、オリゴ糖に加え、レジスタント・プロテインが含まれます。小麦胚芽も食物繊維を豊富に含みます。
- 「寿命を延ばす食物は何か」では、野菜や果物が含むファイトケミカルがカロリー制限模倣物質として機能することを説明しました。それに加えて、野菜や果物は全般的にプレバイオティクスの宝庫です。
プレバイオティクスとプロバイオティクスは、たんに下痢や便秘を防ぐだけでなく、心身の健康に重要な役割を果たしています。本稿がみなさんの腸活に参考になるなら、幸いです。
4. 動画による要約のまとめ
5. 参照情報
- ↑ Turner, Elizabeth C. “Possible Poriferan Body Fossils in Early Neoproterozoic Microbial Reefs.” Nature 596, no. 7870 (August 2021): 87–91.
- ↑ Murillo-Rincon, Andrea P., Alexander Klimovich, Eileen Pemöller, Jan Taubenheim, Benedikt Mortzfeld, René Augustin, and Thomas C. G. Bosch. “Spontaneous Body Contractions Are Modulated by the Microbiome of Hydra.” Scientific Reports 7, no. 1 (November 21, 2017): 15937.
- ↑ Sugahara, Fumiaki, Juan Pascual-Anaya, Yasuhiro Oisi, Shigehiro Kuraku, Shin-ichi Aota, Noritaka Adachi, Wataru Takagi, et al. “Evidence from Cyclostomes for Complex Regionalization of the Ancestral Vertebrate Brain.” Nature 531, no. 7592 (March 2016): 97–100.
- ↑ Progatzky, Fränze, Michael Shapiro, Song Hui Chng, Bethania Garcia-Cassani, Cajsa Helena Classon, Selin Sevgi, Anna Laddach, et al. “Regulation of Intestinal Immunity and Tissue Repair by Enteric Glia.” Nature 599, no. 7883 (November 2021): 125–30.
- ↑ Yoo, Bryan B., and Sarkis K. Mazmanian. “The Enteric Network: Interactions between the Immune and Nervous Systems of the Gut.” Immunity 46, no. 6 (June 20, 2017): 910–26.
- ↑ Kagnoff, M. F. “Immunology of the digestive system.” Physiology of the gastrointestinal tract Ed. LR Johnson. New York: Raven Press 2 (1987): 1699-1728.
- ↑ Tubbs, R.S., Rizk, E., Shoja, M.M., Loukas, M., Barbaro, N., Spinner, R.J., Nerves and Nerve Injuries: Vol 1: History, Embryology, Anatomy, Imaging, and Diagnostics. Academic Press. 2015. Cf. Agostoni, E., J. E. Chinnock, M. De Burgh Daly, and J. G. Murray. “Functional and Histological Studies of the Vagus Nerve and Its Branches to the Heart, Lungs and Abdominal Viscera in the Cat.” The Journal of Physiology 135, no. 1 (January 23, 1957): 182–205.
- ↑ Liu, Yunpeng, and Paul Forsythe. “Vagotomy and Insights into the Microbiota-Gut-Brain Axis.” Neuroscience Research, Neuro-Molecular Understanding for the Gut-Brain Axis, 168 (July 1, 2021): 20–27.
- ↑ Bravo, Javier A., Paul Forsythe, Marianne V. Chew, Emily Escaravage, Hélène M. Savignac, Timothy G. Dinan, John Bienenstock, and John F. Cryan. “Ingestion of Lactobacillus Strain Regulates Emotional Behavior and Central GABA Receptor Expression in a Mouse via the Vagus Nerve.” Proceedings of the National Academy of Sciences 108, no. 38 (September 20, 2011): 16050–55.
- ↑ Ghia, Jean Eric, Patricia Blennerhassett, Harry Kumar–Ondiveeran, Elena F. Verdu, and Stephen M. Collins. “The Vagus Nerve: A Tonic Inhibitory Influence Associated With Inflammatory Bowel Disease in a Murine Model.” Gastroenterology 131, no. 4 (October 1, 2006): 1122–30.
- ↑ Johnson, Katerina V. -A. “Gut Microbiome Composition and Diversity Are Related to Human Personality Traits.” Human Microbiome Journal 15 (March 1, 2020): 100069.
- ↑ J. M. W. Silver. “Sketches of Japanese Manners and Customs.” Published in London in 1867. Licensed under CC-0.
- ↑ Liu, Richard T., Rachel F. L. Walsh, and Ana E. Sheehan. “Prebiotics and Probiotics for Depression and Anxiety: A Systematic Review and Meta-Analysis of Controlled Clinical Trials.” Neuroscience & Biobehavioral Reviews 102 (July 1, 2019): 13–23.
- ↑ Fatahi, Somaye, Shakiba Shoaee Matin, Mohammad Hassan Sohouli, Mihnea-Alexandru Găman, Pourya Raee, Beheshteh Olang, Vaani Kathirgamathamby, Heitor O. Santos, Nathalia Sernizon Guimarães, and Farzad Shidfar. “Association of Dietary Fiber and Depression Symptom: A Systematic Review and Meta-Analysis of Observational Studies.” Complementary Therapies in Medicine 56 (January 1, 2021): 102621.
- ↑ 河合光久, 加藤豪人, 高田麻衣, 星亮太郎, 西田憲生「Lactobacillus casei Shirota株の高菌数,高密度化技術と脳腸軸を介した新規保健機能研究」『日本栄養・食糧学会誌』2021, 74 巻, 2 号, p. 75-78. 公開日 2021/04/14/
- ↑ 株式会社ヤクルト本社「Y1000商品情報」30 Sep 2022.
- ↑ 柏原幸代. “20~50代女性の4割が「腸活をしたことがある」と回答.” 一般社団法人日本健康食育協会. 2022年10月18日.
- ↑ Lu, Yukai, Yumi Sugawara, Sanae Matsuyama, Akira Fukao, and Ichiro Tsuji. “Association of Dairy Intake with All-Cause, Cancer, and Cardiovascular Disease Mortality in Japanese Adults: A 25-Year Population-Based Cohort.” European Journal of Nutrition 61, no. 3 (April 1, 2022): 1285–97.
- ↑ Gao, Xiang, Hai-yi Jia, Guo-chong Chen, Cheng-yue Li, and Mo Hao. “Yogurt Intake Reduces All-Cause and Cardiovascular Disease Mortality: A Meta-Analysis of Eight Prospective Cohort Studies.” Chinese Journal of Integrative Medicine 26, no. 6 (June 1, 2020): 462–68.
- ↑ Tong, Xing, Guo-Chong Chen, Zheng Zhang, Yu-Lu Wei, Jia-Ying Xu, and Li-Qiang Qin. “Cheese Consumption and Risk of All-Cause Mortality: A Meta-Analysis of Prospective Studies.” Nutrients 9, no. 1 (January 13, 2017): 63.
- ↑ Mazidi, Mohsen, Dimitri P. Mikhailidis, Naveed Sattar, George Howard, Ian Graham, and Maciej Banach. “Consumption of Dairy Product and Its Association with Total and Cause Specific Mortality – A Population-Based Cohort Study and Meta-Analysis.” Clinical Nutrition 38, no. 6 (December 1, 2019): 2833–45.
- ↑ McLoughlin, Rebecca F, Bronwyn S Berthon, Megan E Jensen, Katherine J Baines, and Lisa G Wood. “Short-Chain Fatty Acids, Prebiotics, Synbiotics, and Systemic Inflammation: A Systematic Review and Meta-Analysis.” The American Journal of Clinical Nutrition 106, no. 3 (September 1, 2017): 930–45.
- ↑ Mao, Ting, Fansu Huang, Xuping Zhu, Dong Wei, and Lianmeng Chen. “Effects of Dietary Fiber on Glycemic Control and Insulin Sensitivity in Patients with Type 2 Diabetes: A Systematic Review and Meta-Analysis.” Journal of Functional Foods 82 (July 1, 2021): 104500.
- ↑ Chen, Jia-Ping, Guo-Chong Chen, Xiao-Ping Wang, Liqiang Qin, and Yanjie Bai. “Dietary Fiber and Metabolic Syndrome: A Meta-Analysis and Review of Related Mechanisms.” Nutrients 10, no. 1 (January 2018): 24.

コメント